题目内容
3.下列溶液中溶质的物质的量浓度为1mol•L-1的是( )| A. | 将40 g NaOH固体溶于1 L水中所得的溶液 | |
| B. | 将22.4 L HCl气体溶于水配成1 L溶液 | |
| C. | 1 L含K+的物质的量为2 mol的K2SO4溶液 | |
| D. | 将100 mL 0.5 mol•L-1的NaNO3溶液加热蒸发掉50 g水后所得的溶液 |
分析 A.体积指溶液体积等于溶剂体积;
B.根据温度、压强对气体摩尔体积的影响分析判断;
C.根据K2SO4的化学式知,溶液中c(K+)=2c(K2SO4),而c(K+)=$\frac{n}{V}$即可计算;
D.根据蒸发掉50g水后溶液体积不是50mL.
解答 解:A.体积指溶液体积不是溶剂体积,所以40gNaOH溶解于1L水中配成的NaOH溶液浓度不是1mol/L,故A错误;
B.氯化氢所处的状态不一定是标准状况,不能使用气体摩尔体积22.4L/mol,体积一定,影响气体的物质的量的因素有温度、压强,22.4LHCl气体的物质的量不一定是1mol,故B错误;
C.1 L含K+的物质的量为2 mol的K2SO4溶液中,c(K+)=$\frac{2mol}{1L}$=2mol/L,故c(K2SO4)=2mol/L×$\frac{1}{2}$=1mol/L,故C正确;
D.加热蒸发掉50g水后的溶液体积不是50mL,则溶液浓度不是1mol/L,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,明确物质的量浓度的概念及计算方法为解答关键,试题培养了学生的分析能力及化学计算能力

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列是一些化学键的键能.
根据键能数据估算下列反应CH4 (g)+4F2 (g)═CF4+4HF(g)的反应热△H为( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940 kJ•mol-1 | B. | 1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | 485 kJ•mol-1 |
18.依据下表所列实验及现象得出的结论不正确的是( )
| 实验项目 | 实验现象 |
| FeCl3溶液中加入维生素C | 溶液褪色为浅绿色 |
| 饱和FeCl3溶液滴入沸水中 | 得到红褐色液体 |
| 将铜锈放入盐酸中 | 有无色气泡产生 |
| A. | 维生素C具有还原性 | B. | FeCl3水解生成Fe(OH)3胶体 | ||
| C. | 铜锈与盐酸反应有H2生成 | D. | 铜锈中含有碳酸根 |
12.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH-2e-═Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-═2Ag+2OH-,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )
| A. | 锌是负极,氧化银是正极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH逐渐增大 |


 .
. B、
B、 C、
C、 D、
D、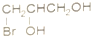

 ,其化学键的类型为离子键、共价键.
,其化学键的类型为离子键、共价键. ;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka=4×10?12(提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)
;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka=4×10?12(提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)