题目内容
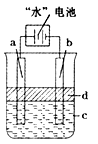
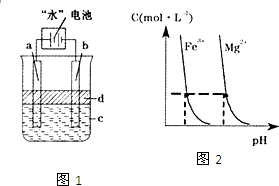 “水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有
“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有(3)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图1,已知两电极的材料分别为石墨和铁.
①若图中的电池为“水”电池,则其与a极相连的电极是由下列物质中的
A.MnO2 B.Ag C.NaCl D.Na2Mn5O10 E.AgCl
②a极的电极反应式为
③电解液c可以是
A.纯水 B.NaCl溶液 C.H2SO4溶液 D.CuCl2溶液
④当生成1mol Fe(OH)2白色沉淀时将消耗MnO2
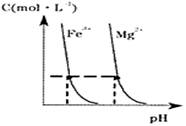
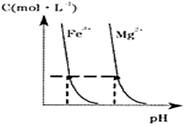
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如图2.请据图2分析:①该温度下,溶度积常数的关系为:KSP[Fe(OH)3]
KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
分析:(1)纳米材料具有较强的吸附性能,能加大吸附面积;
(2)原电池的负极上发生的是失电子的氧化反应;
(3)①根据电解池的工作原理来确定电极材料以及电解质溶液;
②电解池中阳极是活泼金属时,则电极本身发生失电子的氧化反应;
③在电解池的阴极上是阳离子发生得电子的还原反应,根据总反应来确定电解质的选择;
④根据电子守恒进行计算;
(4)①根据Ksp的意义以及沉淀的转化知识来判断生成的沉淀是什么;
②根据沉淀溶解平衡移动的影响因素知识来回答判断.
(2)原电池的负极上发生的是失电子的氧化反应;
(3)①根据电解池的工作原理来确定电极材料以及电解质溶液;
②电解池中阳极是活泼金属时,则电极本身发生失电子的氧化反应;
③在电解池的阴极上是阳离子发生得电子的还原反应,根据总反应来确定电解质的选择;
④根据电子守恒进行计算;
(4)①根据Ksp的意义以及沉淀的转化知识来判断生成的沉淀是什么;
②根据沉淀溶解平衡移动的影响因素知识来回答判断.
解答:解:(1)纳米材料具有较强的吸附性能,能加大吸附面积,该电池用二氧化锰纳米棒为正极材料可提高发电效率,故答案为:较强吸附能力;
(2)根据电池的总反应:5MnO2+2Ag+2NaCL=Na2Mn5O10+2AgCl,失电子的是金属银,而原电池的负极上发生的是失电子的氧化反应,所以负极反应是Ag+Cl--e-=AgCl↓,故答案为:Ag+Cl--e-=AgCl↓;
(3)①做电极的材料是可以导电的金属单质、非金属单质或是其他固体物质,故NaCl、Na2Mn5O10、AgCl都不可以,金属银作阳极会发生金属银失电子的氧化反应,故不行,故答案为:A;
②电解池中阳极是活泼金属时,则电极本身发生失电子的氧化反应,制取氢氧化亚铁时,金属铁在阳极上反应,即Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
③在电解池的阴极上是阳离子氢离子发生得电子的还原反应,氢氧根浓度增加,所以会出现氢氧化铁,合适的电解质只能是氯化钠溶液,故答案为:B;
④根据电池反应:5MnO2+2Ag+2NaCL=Na2Mn5O10+2AgCl,当生成1molFe(OH)2白色沉淀时将转移2mol电子,所以消耗MnO2的物质的量是5mol,故答案为:5;
(4)①根据图象上的点可以知道,当阳离子铁离子、镁离子浓度相等时,对应的氢离子浓度的大小关系,结合Ksp(氢氧化铁)=c(Fe3+)?c(OH-)3,Ksp(氢氧化镁)=c(Mg2+)?c(OH-)2,所以KSP[Fe(OH)3]<KSP[Mg(OH)2],故答案为:<;
②根据①的分析,KSP[Fe(OH)3]<KSP[Mg(OH)2],氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,机会生成红褐色沉淀物质,
故答案为:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀.
(2)根据电池的总反应:5MnO2+2Ag+2NaCL=Na2Mn5O10+2AgCl,失电子的是金属银,而原电池的负极上发生的是失电子的氧化反应,所以负极反应是Ag+Cl--e-=AgCl↓,故答案为:Ag+Cl--e-=AgCl↓;
(3)①做电极的材料是可以导电的金属单质、非金属单质或是其他固体物质,故NaCl、Na2Mn5O10、AgCl都不可以,金属银作阳极会发生金属银失电子的氧化反应,故不行,故答案为:A;
②电解池中阳极是活泼金属时,则电极本身发生失电子的氧化反应,制取氢氧化亚铁时,金属铁在阳极上反应,即Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
③在电解池的阴极上是阳离子氢离子发生得电子的还原反应,氢氧根浓度增加,所以会出现氢氧化铁,合适的电解质只能是氯化钠溶液,故答案为:B;
④根据电池反应:5MnO2+2Ag+2NaCL=Na2Mn5O10+2AgCl,当生成1molFe(OH)2白色沉淀时将转移2mol电子,所以消耗MnO2的物质的量是5mol,故答案为:5;
(4)①根据图象上的点可以知道,当阳离子铁离子、镁离子浓度相等时,对应的氢离子浓度的大小关系,结合Ksp(氢氧化铁)=c(Fe3+)?c(OH-)3,Ksp(氢氧化镁)=c(Mg2+)?c(OH-)2,所以KSP[Fe(OH)3]<KSP[Mg(OH)2],故答案为:<;
②根据①的分析,KSP[Fe(OH)3]<KSP[Mg(OH)2],氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,机会生成红褐色沉淀物质,
故答案为:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀.
点评:本题是要综合知识考查题,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
相关题目

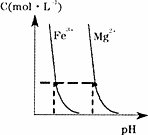
 该电池的负极反应式为 。
该电池的负极反应式为 。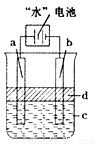
 该电池的负极反应式为 。
该电池的负极反应式为 。