题目内容
(8分)在反应2KMnO4+16HCl==2KCl+2MnCl2+5Cl2+8H2O中:
氧化剂是 氧化产物是 氧化产物与还原产物的物质的量之比为
被氧化与未被氧化的HCl的质量之比为 ,若有73克HCl被氧化,电子转移的总数为 ,标准状况下生成Cl2的体积为 L.用单线桥标出电子转移的方向和数目
氧化剂是 氧化产物是 氧化产物与还原产物的物质的量之比为
被氧化与未被氧化的HCl的质量之比为 ,若有73克HCl被氧化,电子转移的总数为 ,标准状况下生成Cl2的体积为 L.用单线桥标出电子转移的方向和数目
(共8分) KMnO4 Cl2 5:2 5:3 2NA 22.4 (以上每空各1分)单线桥略 (2分)
反应中锰元素由+7价降至+2价,而部分氯元素由—1价升至0价,故氧化剂是KMnO4,还原产物为MnCl2,还原剂是HCl,氧化产物为Cl2;
氧化产物Cl2与还原产物MnCl2的物质的量比为5:2
被氧化与未被氧化的HCl的质量之比为10:8=5:3
若有73克HCl被氧化,电子转移的总数为 =2mol;而Cl2+2e-=2Cl-可知生成的氯气的体积为1×22.4=22.4L
=2mol;而Cl2+2e-=2Cl-可知生成的氯气的体积为1×22.4=22.4L
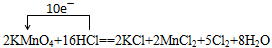
氧化产物Cl2与还原产物MnCl2的物质的量比为5:2
被氧化与未被氧化的HCl的质量之比为10:8=5:3
若有73克HCl被氧化,电子转移的总数为
 =2mol;而Cl2+2e-=2Cl-可知生成的氯气的体积为1×22.4=22.4L
=2mol;而Cl2+2e-=2Cl-可知生成的氯气的体积为1×22.4=22.4L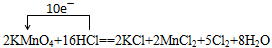

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 NO2
NO2 Na2O2
Na2O2
 Al(OH)3+3H+
Al(OH)3+3H+
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑