题目内容
将0.05 mol·L-1的HCl溶液和未知浓度的NaOH溶液以1∶2的体积比混合,所得溶液的pH=12。用上述NaOH溶液滴定pH=3的某一元弱碱溶液20 mL,终点时消耗NaOH 12.6 mL,试求:(1)NaOH的物质的量浓度。
(2)此一元弱酸的物质的量浓度。
(1)0.04 mol·L-1 (2)0.025 2 mol·L-1 解析:(1) (2)V(NaOH)×c(NaOH)=V(弱酸)·c(弱酸) 得12.6 mL×0.04 mol·L-1=20 mL×c(弱酸),c(弱酸)=0.025 2 mol·L-1
![]() =10-2 mol·L-1,c(OH-)=0.04 mol·L-1
=10-2 mol·L-1,c(OH-)=0.04 mol·L-1 练习册系列答案
练习册系列答案
全真模拟决胜期末100分系列答案
新课程同步学案专家伴读系列答案
高效学习有效课堂课时作业本系列答案
千里马语文课外阅读训练系列答案
千里马英语阅读理解与写作系列答案
新课改课堂口算系列答案
七彩口算题卡系列答案
自我提升与评价系列答案
一课一卷随堂检测系列答案
壹学教育计算天天练系列答案
相关题目
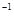 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求: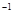 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求: