题目内容
【题目】欲证明Ba(OH)2·8H2O和NH4Cl晶体的反应是吸热反应,设计实验如图所示。下列说法错误的是
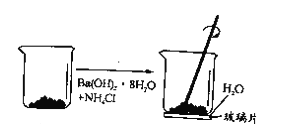
A.实验中观察玻璃片上的水是否会结冰并和烧杯粘在-起
B.实验过程中可闻到刺激性的氨味
C.该反应不能自发进行
D.玻璃棒搅拌可以加快反应
【答案】C
【解析】
A项、若Ba(OH)2·8H2O和NH4Cl晶体的反应是吸热反应,会导致温度降低,使玻璃片上的水结冰,导致玻璃片和烧杯粘在-起,故A正确;
B项、Ba(OH)2·8H2O和NH4Cl晶体反应生成氯化钡和氨气,可闻到刺激性的氨味,故B正确;
C项、该反应为熵增的反应,常温可自发进行,故C错误;
D项、用玻璃棒搅拌可以增大反应物的接触面积,使反应速率加快,故D正确;
故选C。

练习册系列答案
相关题目