题目内容
5.设NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 2.3g金属钠与氧气反应变成钠离子时,失去的电子数目为0.1NA | |
| B. | 2.7g铝与足量的氢氧化钠溶液反应,消耗氢氧根离子数目是0.2NA | |
| C. | 17gNH3所含的质子数为NA | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠反应,转移电子数目是2NA |
分析 A、求出钠的物质的量,然后根据反应后钠元素变为+1价来分析;
B、求出铝的物质的量,然后根据1mol铝~1mol氢氧根来分析;
C、求出氨气的物质的量,然后根据氨气为10质子微粒来分析;
D、求出氯气的物质的量,然后根据氯气与氢氧化钠的反应为歧化反应来分析.
解答 解:A、2.3g钠的物质的量为0.1mol,而反应后钠元素变为+1价,故0.1mol钠失去0.1mol电子即0.1NA个,故A正确;
B、2.7g铝的物质的量为0.1mol,而1mol铝~1mol氢氧根,故0.1mol铝消耗0.1mol氢氧根即0.1NA个,故B错误;
C、17g氨气的物质的量为1mol,而氨气为10质子微粒,故1mol氨气中含10mol质子即10NA个,故C错误;
D、标况下22.4L氯气的物质的量为1mol,而氯气与氢氧化钠的反应为歧化反应,故1mol氯气转移1mol电子即NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
16.根据键能数据估算CH4(g)+4F2(g)═CF4+4HF(g)的反应热△H为( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ/mol) | 414 | 489 | 565 | 155 |
| A. | -485kj/mol | B. | +485kj/mol | C. | +l940kj/mol | D. | -l940kj/mol |
13.下列关于 0.2mol/L 硝酸钾溶液的叙述中,正确的是( )
| A. | 1 L 该溶液中含硝酸钾 202g | |
| B. | 100 mL 该溶液中含硝酸钾 0.02mol | |
| C. | 从 1 L 该溶液中取出 500mL 后,剩余溶液的浓度为 0.1mol/L | |
| D. | 1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2mol/L 硝酸钾溶液 |
20.下列关于物质的性质与应用相对应的是( )
| A. | 氯气有毒,不可用作自来水的杀菌消毒 | |
| B. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| C. | 浓硫酸具有吸水性和强氧化性,可以干燥Cl2,但不能干燥SO2 | |
| D. | 铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
10.下列物质所含的H原子数与0.5mol H2O所含H原子数相等的是( )
| A. | 0.6mol H2O2 | B. | 标准状况下22.4L HCl | ||
| C. | 98g H2SO4 | D. | 3.01×1023 个NH3 |
17.下列关于Na2CO3的说法中正确的是( )
| A. | Na2CO3溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) | |
| B. | Na2CO3溶液中滴加酚酞呈红色,加热红色变浅 | |
| C. | 0.1mol•L-1的Na2CO3溶液中c(Na+)>2c(CO32-) | |
| D. | 相同温度下,CaCO3在饱和Na2CO3溶液中的KSP比在纯水中的小 |
3.N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是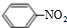 .
.
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②如表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为0.00296 mol•L-1•s-1.
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1(填>、<或=).
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2.

写出石墨Ⅰ电极上发生反应的电极反应式H2+CO32--2e-═H2O+CO2,N2O5在电解池的阳极区生成(填“阳极”或“阴极”).
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
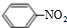 .
.(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②如表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1(填>、<或=).
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2.

写出石墨Ⅰ电极上发生反应的电极反应式H2+CO32--2e-═H2O+CO2,N2O5在电解池的阳极区生成(填“阳极”或“阴极”).