题目内容
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
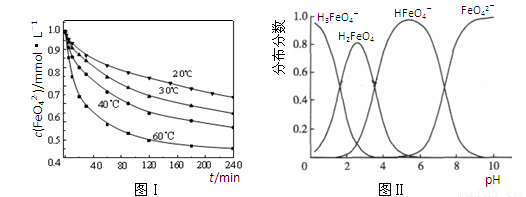
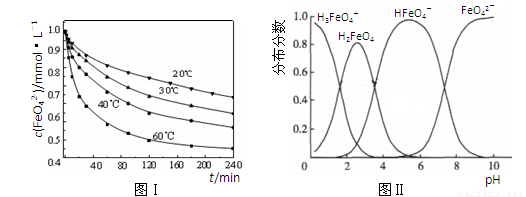
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:

(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
(共13分)
(1)杀菌消毒、吸附悬浮物(或其他合理答案)(各1分,共2分)
(2)探究温度对FeO42-浓度的影响(或其他合理答案)(1分) >(1分)
(3)C(1分)
(4)黑暗可以防止晶体分解(1分) (5)过滤、洗涤(各1分,共2分)
(6)250mL容量瓶、酸式滴定管(2分) 紫红(1分) (7) K3Fe(C2O4)3·3H2O(2分)
【解析】(1)K2FeO4中的铁元素化合物高,有很强的氧化性具有杀菌的作用,又因水解可生成胶体,可吸附悬浮物,可用来净水。
(2)(3)均是通过图像收集信息,结合题意及知识的积累进行概念总结。起点高落点低。
(4)(5)(6)考查一些基本的实验操作
(7)MnO4- + 5Fe2+ + 8H+ = Mn2++5Fe3++4H2O
0.0002mol 0.001mol
2KMnO4 + 5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
0.0012mol 0.003mol
故:可知化学式KxFe(C2O4) y·zH2O的y =3,由化合价进一步可知x=3
由0.491g减去KxFe(C2O4) y·的质量,可求出H2O 的质量为0.054g,即0.003mol

 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。

 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。