��Ŀ����
��һ�������£�����A��E�ת���Ĺ�ϵ����ͼ��ʾ������AΪ���ʣ�������E����ɫҺ�壮����������ش��������⣨��д��ѧ�������1����A��C��D�о�������Ԫ�أ������ȵĻ��ϼ��ɵ͵��ߵ�˳��ΪC��A��D��CΪ�ȼҵ��ԭ�ϣ�D����Һ��Ư���ԣ���D�ĵ���ʽΪ ����A��B��Ӧ�����ӷ���ʽ�� ��
��2����BΪ������ij��Ԫ��X������������ˮ���
����AΪ����ɫ���壬�ڼ�������������B��Ũ��Һ��Ӧ����������B��ϡ��Һ��Ӧ����Ԫ��x�����ڱ��е�λ���� �����ڳ�����A��B��Ũ��ϡ��Һ���ܷ�Ӧ����A��B��ϡ��Һ��Ӧ�ĸ��ڷ���ʽ�� ��
����AΪ��ɫ���壬�ڼ�����������B��Ũ��Һ��Ӧ����������ɫ���壬��˷�Ӧ�Ļ�ѧ����ʽ�� ��
��3����֪��1���е�B��Һ�������������M�루2���е�B��Һ�������������N����10�������ӣ���100mL 0.5mol/L��M��100mL 0.55mol/LN��ȫ��Ӧ����Eʱ�ų�akJ�������÷�Ӧ���Ȼ�ѧ����ʽΪ ��

���𰸡���������1��A��C��D�о�������Ԫ�أ�AΪ���ʣ�ӦΪCl2��������E����ɫҺ�壬ӦΪH2O��A��B�÷�ӦΪ�����ͼ�ķ�Ӧ��CΪ�ȼҵ��ԭ�ϣ�ΪNaCl��D����Һ��Ư���ԣ�ӦΪNaClO��
��2������AΪ����ɫ���壬�ڼ�������������B��Ũ��Һ��Ӧ����������B��ϡ��Һ��Ӧ��ӦΪCu��Ũ����ķ�Ӧ�����ڳ�����A��B��Ũ��ϡ��Һ���ܷ�Ӧ����ΪCu������ķ�Ӧ��
����AΪ��ɫ���壬�ڼ�����������B��Ũ��Һ��Ӧ����������ɫ���壬ӦΪC��Ũ����ķ�Ӧ��
��3����1���е�B��Һ�������������ΪOH-����2���е�B��Һ�������������ΪH3O+��
����⣺��1��A��C��D�о�������Ԫ�أ�AΪ���ʣ�ӦΪCl2��������E����ɫҺ�壬ӦΪH2O��A��B�÷�ӦΪ�����ͼ�ķ�Ӧ��CΪ�ȼҵ��ԭ�ϣ�ΪNaCl��D����Һ��Ư���ԣ�ӦΪNaClO������ʽΪ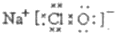 ��A��B��ӦΪCl2��NaOH�ķ�Ӧ����Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+H2O��
��A��B��ӦΪCl2��NaOH�ķ�Ӧ����Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+H2O��
�ʴ�Ϊ��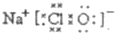 ��Cl2+2OH-=Cl-+ClO-+H2O��
��Cl2+2OH-=Cl-+ClO-+H2O��
��2��������AΪ����ɫ���壬�ڼ�������������B��Ũ��Һ��Ӧ����������B��ϡ��Һ��Ӧ��ӦΪCu��Ũ����ķ�Ӧ��Sλ�����ڱ��������ڵڢ�A�壬
���ڳ�����A��B��Ũ��ϡ��Һ���ܷ�Ӧ����ΪCu������ķ�Ӧ��Cu��ϡ���ᷴӦ�����ӷ���ʽΪ3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
�ʴ�Ϊ���������ڵڢ�A�壻3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
����AΪ��ɫ���壬�ڼ�����������B��Ũ��Һ��Ӧ����������ɫ���壬ӦΪC��Ũ����ķ�Ӧ����Ӧ�Ļ�ѧ����ʽΪC+2H2SO4��Ũ��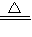 CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O��
�ʴ�Ϊ��C+2H2SO4��Ũ��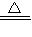 CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O��
��3����1���е�B��Һ�������������ΪOH-����2���е�B��Һ�������������ΪH3O+��n��H3O+��=0.1L×0.5mol/L=0.05mol����ȫ��Ӧʱ�ų�akJ������
����H3O+��aq��+OH-��aq��=2H2O��l����H=-20akJ/mol��
�ʴ�Ϊ��H3O+��aq��+OH-��aq��=2H2O��l����H=-20akJ/mol��
���������⿼��������ƶϣ���Ŀ�ѶȽϴ���ע����ݳ���Ԫ�ػ���������ʽ����ƶϣ����ñ��⣬������ʵ�Ļ���֪ʶ�ǹؼ���
��2������AΪ����ɫ���壬�ڼ�������������B��Ũ��Һ��Ӧ����������B��ϡ��Һ��Ӧ��ӦΪCu��Ũ����ķ�Ӧ�����ڳ�����A��B��Ũ��ϡ��Һ���ܷ�Ӧ����ΪCu������ķ�Ӧ��
����AΪ��ɫ���壬�ڼ�����������B��Ũ��Һ��Ӧ����������ɫ���壬ӦΪC��Ũ����ķ�Ӧ��
��3����1���е�B��Һ�������������ΪOH-����2���е�B��Һ�������������ΪH3O+��
����⣺��1��A��C��D�о�������Ԫ�أ�AΪ���ʣ�ӦΪCl2��������E����ɫҺ�壬ӦΪH2O��A��B�÷�ӦΪ�����ͼ�ķ�Ӧ��CΪ�ȼҵ��ԭ�ϣ�ΪNaCl��D����Һ��Ư���ԣ�ӦΪNaClO������ʽΪ
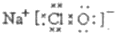 ��A��B��ӦΪCl2��NaOH�ķ�Ӧ����Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+H2O��
��A��B��ӦΪCl2��NaOH�ķ�Ӧ����Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+H2O���ʴ�Ϊ��
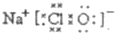 ��Cl2+2OH-=Cl-+ClO-+H2O��
��Cl2+2OH-=Cl-+ClO-+H2O����2��������AΪ����ɫ���壬�ڼ�������������B��Ũ��Һ��Ӧ����������B��ϡ��Һ��Ӧ��ӦΪCu��Ũ����ķ�Ӧ��Sλ�����ڱ��������ڵڢ�A�壬
���ڳ�����A��B��Ũ��ϡ��Һ���ܷ�Ӧ����ΪCu������ķ�Ӧ��Cu��ϡ���ᷴӦ�����ӷ���ʽΪ3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
�ʴ�Ϊ���������ڵڢ�A�壻3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
����AΪ��ɫ���壬�ڼ�����������B��Ũ��Һ��Ӧ����������ɫ���壬ӦΪC��Ũ����ķ�Ӧ����Ӧ�Ļ�ѧ����ʽΪC+2H2SO4��Ũ��
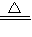 CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O���ʴ�Ϊ��C+2H2SO4��Ũ��
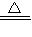 CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O����3����1���е�B��Һ�������������ΪOH-����2���е�B��Һ�������������ΪH3O+��n��H3O+��=0.1L×0.5mol/L=0.05mol����ȫ��Ӧʱ�ų�akJ������
����H3O+��aq��+OH-��aq��=2H2O��l����H=-20akJ/mol��
�ʴ�Ϊ��H3O+��aq��+OH-��aq��=2H2O��l����H=-20akJ/mol��
���������⿼��������ƶϣ���Ŀ�ѶȽϴ���ע����ݳ���Ԫ�ػ���������ʽ����ƶϣ����ñ��⣬������ʵ�Ļ���֪ʶ�ǹؼ���

��ϰ��ϵ�д�
�����Ŀ
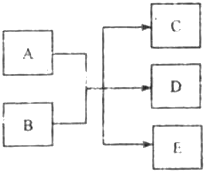 ��2011?������һģ����һ�������£�����A��E�ת���Ĺ�ϵ����ͼ��ʾ������AΪ���ʣ�������E����ɫҺ�壮����������ش��������⣨��д��ѧ�����
��2011?������һģ����һ�������£�����A��E�ת���Ĺ�ϵ����ͼ��ʾ������AΪ���ʣ�������E����ɫҺ�壮����������ش��������⣨��д��ѧ�����

 I����Һ�з�Ӧ�����ӷ���ʽ��
I����Һ�з�Ӧ�����ӷ���ʽ��  ��
�� �ܽ��У����Ⱥ���Է�����Ӧ��C����������ˮ����DΪ���γ��������ɫ���塣C���������������Һ��Ӧ�����ӷ���ʽ��
�ܽ��У����Ⱥ���Է�����Ӧ��C����������ˮ����DΪ���γ��������ɫ���塣C���������������Һ��Ӧ�����ӷ���ʽ��  ɫ��������ɫ�����Һ̽��ʹ����ɫ�����ʵ�ʵ�鷽���� ��
ɫ��������ɫ�����Һ̽��ʹ����ɫ�����ʵ�ʵ�鷽���� ��
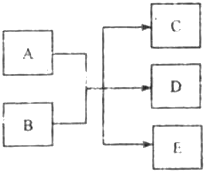 ��һ�������£�����A��E�ת���Ĺ�ϵ����ͼ��ʾ������AΪ���ʣ�������E����ɫҺ�壮����������ش��������⣨��д��ѧ�����
��һ�������£�����A��E�ת���Ĺ�ϵ����ͼ��ʾ������AΪ���ʣ�������E����ɫҺ�壮����������ش��������⣨��д��ѧ�����