题目内容
向一定量铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将溶液稀释到500mL,再加入足量锌粉,充分反应后,收集到2.24L(标准状况)气体,过滤残留固体,干燥后称量,质量比加入的锌粉减轻了7.5g。试求:
(1)加入铜片的质量
(2)原硫酸的物质的量浓度。
【答案】
(1)64g (2)18.3mol/L
【解析】考查根据方程式进行的有关计算。
加入锌粉后的反应方程式为Zn+H2SO4=ZnSO4+H2↑ △m↓
1mol 1mol 22.4L 65g
0.1mol 0.1mol 2.24L 6.5g
Zn+CuSO4=ZnSO4+Cu △m↓
1mol 1mol 1g
1mol 1mol 7.5g-6.5g=1.0g
所以加入的铜是1mol,质量是64g。
根据电子得失守恒可知,在反应中生成的SO2是1mol
根据硫原子守恒可知,原硫酸的物质的量是1mol+1mol+0.1mol=2.1mol
所以其浓度是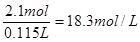

练习册系列答案
相关题目