题目内容
下列说法正确的是
| A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2 |
| C.在c(H+)∶c(OH-)=1∶1012的溶液中,Na+、I-、NO3-、SO42-能大量共存 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
C
试题分析:氯化铵水解促进水的电离,醋酸是酸,抑制水的电离。A不正确,前者由水电离出的c(H+)为10-5 mol/L;醋酸在稀释过程中会促进电离,即氢离子的个数是增加的,因此B不正确,应该是c1>10c2;C中氢离子浓度是10-13 mol/L,即溶液显碱性,可以大量共存,C正确;D不正确,因为不符合电荷守恒,应该是c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-),答案选C。
点评:该题综合性强,浓度较大。需要熟练掌握相关的化学知识,更重要的是能够灵活运用这些知识解决实际问题。尤其是选项B,不易理解和掌握。

练习册系列答案
相关题目
 、Cl-、
、Cl-、
 、I-、
、I-、
 、Al3+、SO42-、CH3COOH
、Al3+、SO42-、CH3COOH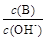 ; ②
; ② 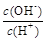 ;
;