题目内容
(8分)有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝
片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1
的NaOH溶液中,如下图所示。
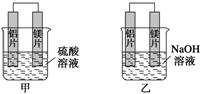
(1)写出甲池中正极的电极反应式:
正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极:________________________________________________________________。
(3)甲同学又将硫酸溶液换为浓硝酸发现有红棕色气体产生,则原电池的正极的电极反应式为
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些正确结论?( )
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_________________________________________________________________(如可靠,此空可不填)。
(1)2H++2e-=H2↑
(2)Al-3e-+4OH-=AlO2-+2H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)4H+ +2NO3-+2e-=2NO2↑+2H2O
(4)Mg ; Al
(5)A D
(6)不可靠 ; 可以根据电流方向判断电池的正负极(或其它合理方案)
【解析】考查原电池中正负极的判断
(1)在原电池中较活泼的金属作负极,失去电子。镁比铝活泼,所以镁是负极,铝是正极,溶液中的氢离子放电,生成氢气,电极反应式为2H++2e-=H2↑。
(2)由于在乙池中铝可以和氢氧化钠反应,镁不能和氢氧化钠反应,虽然镁比铝活泼,但此时作负极的是铝,镁是正极,负极反应式为Al-3e-+4OH-=AlO2-+2H2O,总反应为2Al+2OH-+2H2O=2AlO2-+3H2↑。
(3)由于铝在浓硝酸中会发生钝化,所以此时镁是负极,铝是正极,溶液中的硝酸得到电子,电极反应式为4H+ +2NO3-+2e-=2NO2↑+2H2O。
(4)根据实验现象可判断,甲中镁活泼。乙中铝活泼。因此正确的结论是A和D
(6)根据以上分析可知“直接利用金属活动顺序表判断原电池中的正负极”这种做法是不可靠的。由于在原电池中电子一定是从负极通过导线传递到正极上,所以可以通过测量电子的流向或电流的方向来判断正负极。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案(8分)有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝
片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1
的NaOH溶液中,如下图所示。
(1)写出甲池中正极的电极反应式:
正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极:________________________________________________________________。
(3)甲同学又将硫酸溶液换为浓硝酸发现有红棕色气体产生,则原电池的正极的电极反应式为
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些正确结论?( )
| A.利用原电池反应判断金属活动顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动顺序表已过时,已没有实用价值 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
(14分)
Ⅰ.有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入2 mol/LH2SO4溶液中,乙同学将电极放入2 mol/L的NaOH溶液中,如图:
(1)写出甲池中正极的电极反应式: ;
(2)写出乙池中负极的电极反应式: ;
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填元素符号)。
(4)由此实验,可得到如下哪些正确结论?( )
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动顺序表已过时,已设有实用价值 |
| D.该实验说明化学研究对象复杂、化学反应受条件影响较大,因此应具体问题具体分析 |
 xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。
xC(g) + D(g),反应达到平衡时C的浓度为1.2 mol/L,B的浓度为0.1 mol/L。(1)x= ;
(2)若使容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为
(填“吸热”或“放热”)反应;
(3)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是 (用序号填空)
①4 mol A + 2 mol B
②3 mol C + 1 mol D
③3 mol C + 1 mol D +1 mol B

