题目内容
 (2010?南京二模)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.
(2010?南京二模)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.(1)写出基态Cu+的核外电子排布式
[Ar]3d10
[Ar]3d10
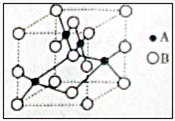
;(2)右图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为
Cu
Cu
;(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到沉淀刚好全部溶解可得到森蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4?H2O沉淀,该物质中的NH3通过
配位
配位
键与中心离子Cu2+结合,NH3分子中N 原子的杂化方式是sp3
sp3
.与NH3分子互为等电子体的一种微粒是PH3或H3O+等
PH3或H3O+等
.(4)CuO的熔点比CuCl的熔点
高
高
.(填“高”或“低”)分析:(1)Cu的原子序数为29,价电子排布为3d104s1;
(2)由晶胞示意图可知,1个晶胞中有4个A,B为8×
+6×
=4个;
(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,形成配位键;NH3分子中孤对电子数为1,成键数为3,与NH3分子互为等电子体的一种微粒具有相同的价电子数和原子数;
(4)离子化合物中,离子半径越小,离子键越强,熔点越高.
(2)由晶胞示意图可知,1个晶胞中有4个A,B为8×
| 1 |
| 8 |
| 1 |
| 2 |
(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,形成配位键;NH3分子中孤对电子数为1,成键数为3,与NH3分子互为等电子体的一种微粒具有相同的价电子数和原子数;
(4)离子化合物中,离子半径越小,离子键越强,熔点越高.
解答:解:(1)Cu的原子序数为29,价电子排布为3d104s1,则基态Cu+的核外电子排布式为[Ar]3d10,
故答案为:[Ar]3d10;
(2)由晶胞示意图可知,1个晶胞中有4个A,B为8×
+6×
=4个,原子个数之比为1:1,该氧化物的化学式为CuO,故答案为:CuO;
(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,二者形成配位键;NH3分子中孤对电子数为1,成键数为3,则N原子的杂化方式为sp3,与NH3分子互为等电子体的一种微粒具有相同的价电子数8和原子数4,微粒为PH3或H3O+等,故答案为:配位;sp3;PH3或H3O+等;
(4)离子化合物中,离子半径越小,离子键越强,熔点越高,离子半径O2-<Cl-,则CuO的熔点比CuCl的熔点高,故答案为:高.
故答案为:[Ar]3d10;
(2)由晶胞示意图可知,1个晶胞中有4个A,B为8×
| 1 |
| 8 |
| 1 |
| 2 |
(3)NH3中N原子提供孤对电子,Cu2+提供空轨道,二者形成配位键;NH3分子中孤对电子数为1,成键数为3,则N原子的杂化方式为sp3,与NH3分子互为等电子体的一种微粒具有相同的价电子数8和原子数4,微粒为PH3或H3O+等,故答案为:配位;sp3;PH3或H3O+等;
(4)离子化合物中,离子半径越小,离子键越强,熔点越高,离子半径O2-<Cl-,则CuO的熔点比CuCl的熔点高,故答案为:高.
点评:本题考查较综合,涉及电子排布、晶胞计算、杂化方式、等电子体、离子晶体熔点比较等,侧重原子结构与性质的考查,题目难度中等.

练习册系列答案
相关题目