题目内容
某烷烃和烯烃混合气2.24L(标准状况),点火使其完全燃烧,将燃烧产物通过浓硫酸后,使硫酸质量增加4.05g;再通过碱石灰,使碱石灰质量增加6.60g,另取等量混合气,通入过量溴水中,溴水质量增加1.05g。
(1)通过计算和分析判断混合气由哪两种烃组成?
(2)计算两烃的物质的量之比。
(1)通过计算和分析判断混合气由哪两种烃组成?
(2)计算两烃的物质的量之比。
可能的组合有(1)CH4与C4H8体积比为:V(CH4)∶V(C4H8)="1∶3"
(2)C2H6与C4H8体积比为:V(C2H6)∶V(C4H8)=1∶1
混合气中的A、B的分子式为C2H6和C4H8。
根据2 L此混合气体可以得到7L水蒸气,所以可得该混合气体的平均分子式为CxH7,又已知两种烃常温下均为气态,所以碳原子数小于或等于4。又烯烃碳原子数大于烷烃碳原子数,所以当烷烃为C3H8时,烯烃必为C4H8,不符合平均分子式CxH7;所以烷烃只能为甲烷或乙烷。根据平均分子式CxH7可以推出CH4与C4H8体积比为1∶3,C2H6与C4H8体积比为1∶1。又因为2L混合气体与9.5L氧气恰好完全燃烧,所以只有C2H6与C4H8符合。

练习册系列答案
相关题目
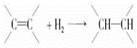 ,则原烯烃可能的结构简式为________________________。
,则原烯烃可能的结构简式为________________________。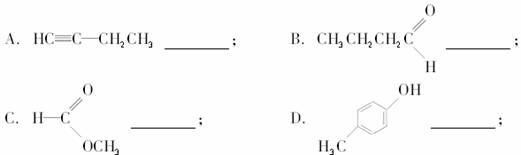
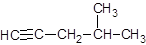 :4-甲基-1-戊炔
:4-甲基-1-戊炔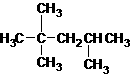 :2,2,3-三甲基戊烷
:2,2,3-三甲基戊烷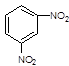 :间二硝基苯
:间二硝基苯