��Ŀ����
��ס��������º��ݵ��ܱ������У��ֱ����һ������A��B��������Ӧ��A(g)��B(g) 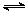 xC(g) ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
xC(g) ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
| ���� | �� | �� |
| �ݻ���L�� | 0.5 | 0.5 |
| ��Ӧ���ȣ�kJ�� | Q1 | Q2 |
| ��Ӧ����ʼ�� | 1 molA 1 molB | 0.5 molA 0.5 molB |
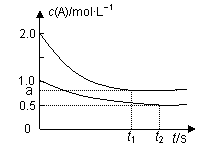
����˵����ȷ����
A��x=1 B��Q1��2Q2 C������������Ϣ������aֵ
D�����������������䣬��ʼʱ������������0.2 mol A��0.2 mol B��0.2 mol C�����ʱv(��)> v(��)
AB

 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д������ѣ�DME������Ϊ��21���͵����ȼ�ϡ����ɺϳ����Ʊ������ѵ���Ҫԭ�����£�
�� CO(g)+2H2(g)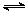 CH3OH(g) ��H 1=��90.7 kJ��mol-1
CH3OH(g) ��H 1=��90.7 kJ��mol-1
�� 2CH3OH(g)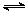 CH3OCH3(g)+H2O(g) ��H 2=��23.5 kJ��mol-1
CH3OCH3(g)+H2O(g) ��H 2=��23.5 kJ��mol-1
�� CO(g)+H2O(g)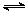 CO2(g)+H2(g) ��H 3=��41.2kJ��mol-1
CO2(g)+H2(g) ��H 3=��41.2kJ��mol-1
�ش��������⣺
��1����Ӧ3H2(g)��3CO(g)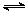 CH3OCH3(g)��CO2(g)�ġ�H�� kJ��mol-1��
CH3OCH3(g)��CO2(g)�ġ�H�� kJ��mol-1��
��2�����д�ʩ�У������CH3OCH3���ʵ��� ��
A��ʹ�ù�����CO B�������¶� C������ѹǿ
��3����Ӧ�������CH3OCH3�IJ��ʣ�ԭ���� ��
��4�����ϳ�����n(H2)/n(CO)=2ͨ��1 L�ķ�Ӧ���У�һ�������·�����Ӧ��
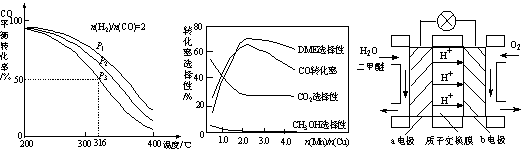
4H2(g)+2CO(g) 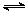 CH3OCH3(g)+H2O(g) ��H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ1��ʾ������˵����ȷ���� ��
CH3OCH3(g)+H2O(g) ��H����CO��ƽ��ת�������¶ȡ�ѹǿ�仯��ϵ��ͼ1��ʾ������˵����ȷ���� ��
A����H <0 B��P1<P2<P3
C������P3��316��ʱ����ʼn(H2)/n(CO)=3����ﵽƽ��ʱ��COת����С��50��
��5������һ�����͵Ĵ�������Ҫ�ɷ���Cu-Mn�ĺϽ𣩣�����CO��H2�Ʊ������ѡ��۲�ͼ2�ش����⡣������n(Mn)/n(Cu)ԼΪ ʱ�������ڶ����ѵĺϳɡ�
��6��ͼ3Ϊ��ɫ��Դ��������ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��a�缫�ĵ缫��ӦʽΪ ��
 |
ͼ1 ͼ2 ͼ3
��7���״�Һ����ˮ���ƶ����ѵ�ԭ���ǣ�CH3OH +H2SO4��CH3HSO4+H2O��
CH3 HSO4+CH3OH��CH3OCH3+H2SO4����ϳ����Ʊ������ѱȽϣ��ù��յ��ŵ��Ƿ�Ӧ�¶ȵͣ�ת���ʸߣ���ȱ���� ��
������ʵ������ƽ���ƶ�ԭ�����͵��ǣ� ��
| 2SO2+O2 ��ƽ����ϵ�У�������18O���ɵ���������SO2�е�18O�ĺ��������� |
|
|
| ||||||||||||||
| A | B | C | D |
 ��Cl��
��Cl��
 ��Cu2+��ClO����Cl��
��Cu2+��ClO����Cl�� ��Cl����NO
��Cl����NO
 2SO3
2SO3
 2HI(g)
2HI(g)