题目内容
【题目】I.芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
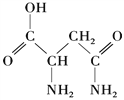
(1)硒、铬、锰元素中,________(填元素符号)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有________种。
(3)已知NN的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,则N2中的________
键稳定(填“σ”或“π”)。
Ⅱ.胆矾CuSO45H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:
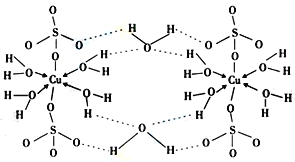
(4)下列说法正确的是_______(填字母)。
A.胆矾所含元素中,H、O、S的半径及电负性依次增大
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.加热条件下胆矾中的水会在相同温度下一同失去
(5)往硫酸铜溶液中加入过量氨水,溶液变为深蓝色,写出所发生反应的离子方程式__________________________;已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________________________。
【答案】 Cr 2 π B Cu2+ + 4NH3 = [Cu(NH3)4]2+ N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F原子,使得N原子上的孤对电子难与Cu2+形成配位键
【解析】(1)硒、铬、锰三种元素的价电子排布式分别是4s24p4、3d54s1、3d54s2,所以Cr元素基态原子核外未成对电子数最多。(2)从结构中看碳原子形成的化学键的类型有单键和双键,碳原子中碳以sp3和sp2两种杂化。(3)三键中含有1个σ键和2个π键,则1个π键键能=(942 kJ·mol-1-247 kJ·mol-1)/2=347.5kJ·mol-1,所以N2中的π键稳定。(4)A.氧元素电负性大于硫,A错误;B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,B正确;C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,C错误;D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,D错误,答案选B。(5)铜离子能与氨气形成配位键,则氢氧化铜能溶解在氨水中,反应的离子方程式为Cu2+ + 4NH3=[Cu(NH3)4]2+;N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,因此使得N原子上的孤对电子难与Cu2+形成配位键。
