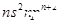题目内容
如图所示为某教材中给出的石英晶体平面结构示意图,它实际上是立体网状结构(可以看作是晶体硅中的每个Si-Si键中插入一个O),其中硅与氧原子个数之比是__________________________;在石英晶体中,由硅、氧原子构成的最小的环上具有的Si、O原子个数是_______________________________________。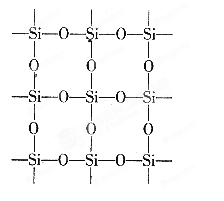

1:2;12(6个Si和6个O)
【错解分析】对石英晶体立体网状结构认识不清楚;三维空间结构的想象能力欠缺。认为结构中Si、O一个一个相接,因此硅氧个数比为1:1;而且从平面结构图看,每个环上有4个Si和4个O,因此环上共有8个原子(4个Si,4个O)。
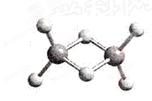
【正解】由石英晶体的平面结构可知(当然立体网状结构也是一样),每个Si周围结合4个O,而每个O跟2个Si结合,所以石英晶体中硅氧原子个数之比为1:2;由于石英晶体是空间网状立体结构,可以看作是晶体硅中的每个硅硅键中插入一个O。且晶体硅的结构和金刚石相似,在金刚石中每个最小的碳环上有6个碳而且有6个碳碳键(如图所示),因此在石英晶体中,由硅、氧原子构成的最小的环上具有的Si、O原子个数是12(6个Si和6个O)。

练习册系列答案
相关题目