��Ŀ����
����Ŀ��A��B��C��D��E�������ʣ������ӣ�������ͬһ��Ԫ�أ�����֮������ͼ��ʾ��ת����ϵ��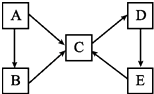
��1����AΪ���ʣ�C��D����Է����������16��0.05 molL��1 E��Һ��ֻ��3�����ӣ�����25��ʱ����Һ�е� ![]() =1012 �� ����BΪ��̬�⻯�д��E��C��һ����ѧ����ʽ ��
=1012 �� ����BΪ��̬�⻯�д��E��C��һ����ѧ����ʽ ��
����A��C�ķ�Ӧ�У�ÿת��1 mol e���ͻ����143.5 kJ��д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��2����AΪ���ʣ�B��C���������࣬D��һ�ְ�ɫ����������B��ˮ��Һ�����ԣ�C��ˮ��Һ�ʼ��ԣ�C��Һ�ʼ��Ե�ԭ�����������ӷ���ʽ��ʾ����
����B��Һ�ʻ�ɫ�������軯����Һ��Ϻ��Ժ�ɫ��E��һ�ֲ����Լ��
����B��C�����ӷ���ʽΪ ��
����D��E�Ļ�ѧ����ʽΪ ��
����ѡ��һ���Լ�R��E��Ӧʵ��E��C��ת������RΪ���÷�Ӧ�����ӷ���ʽΪ ��
��3����A��E��Ϊ������Ҿ�����Ԫ��Y��A�ǵ���ɫ���壬B��C����Һ�ڵ����ʵ���Ũ��ʱ��C��Һ��pH��С�����D��ˮ��Һ������Ҫ�Ĺ�ҵ����֮һ��D��E��CҲ�ǹ�ҵ�Ʊ�C���ձ鷽����Y�ĵ�����صĺϽ���ں˷�Ӧ���������Ƚ���Һ��5.05 g Y�غϽ�����200 mLˮ����0.075 mol���������㲢ȷ����Y�غϽ�Ļ�ѧʽ�� ��
���𰸡�
��1��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��C+2H2SO4��Ũ��
CuSO4+SO2��+2H2O��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O��S��g��+O2��g���TSO2��g����H=��574.0kJ/mol
CO2��+2SO2��+2H2O��S��g��+O2��g���TSO2��g����H=��574.0kJ/mol
��2��Al3++3H2O?Al��OH��3+3H+��2Fe3++Fe�T3Fe2+��4Fe��OH��2+O2+2H2O�T4Fe��OH��3������ᣨ��HI����2Fe��OH��3+6H++2I���T2Fe2++I2+6H2O
��3��NaK2
���������⣺��1��AΪ�������ʣ�C��D����Է����������16��0.05mol/L E��Һ��ֻ��3�����ӣ�������Һ�е� ![]() =1012 �� ����Һ�е�c��H+��=0.1mol/L����EΪ���ᣬ����AΪS��CΪSO2 �� DΪSO3 �� BΪ���壬ӦΪH2S����E��C�Ļ�ѧ����ʽΪCu+2H2SO4��Ũ��
=1012 �� ����Һ�е�c��H+��=0.1mol/L����EΪ���ᣬ����AΪS��CΪSO2 �� DΪSO3 �� BΪ���壬ӦΪH2S����E��C�Ļ�ѧ����ʽΪCu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��C+2H2SO4��Ũ��
CuSO4+SO2��+2H2O��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O�����Դ��ǣ�Cu+2H2SO4��Ũ��
CO2��+2SO2��+2H2O�����Դ��ǣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��C+2H2SO4��Ũ��
CuSO4+SO2��+2H2O��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O����A��C�ķ�ӦΪS��g��+O2��g���TSO2��g����ÿת��1mol e���ͻ����143.5kJ����ת��4mol��������143.5kJ��4=574.0kJ��������Ӧ���Ȼ�ѧ����ʽΪS��g��+O2��g���TSO2��g����H=��574.0 kJ/mol�����Դ��ǣ�S��g��+O2��g���TSO2��g����H=��574.0 kJ/mol����2����AΪ���ʣ�B��C���������࣬D��һ�ְ�ɫ��������B��ˮ��Һ�����ԣ�C��ˮ��Һ�ʼ��ԣ�����ת����ϵ��֪AΪAl��BΪAlCl3 �� CΪNaAlO2 �� DΪAl��OH��3 �� B��Һ�����Ե�ԭ����������ˮ��ʹ��Һ�����ԣ����ӷ���ʽΪAl3++3H2OAl��OH��3+3H+ �� ���Դ��ǣ�Al3++3H2OAl��OH��3+3H+������B��Һ�ʻ�ɫ���뱽����Һ��Ϻ�����ɫ����˵��B�к���Fe3+ �� AӦΪFe��C�к���Fe2+ �� E��һ�ֲ����Լ��ת����ϵ��֪DΪFe��OH��2 �� EΪFe��OH��3 �� B��C�����ӷ���ʽΪ2Fe3++Fe�T3Fe2+ �� D��E�Ļ�ѧ����ʽΪ4Fe��OH��2+O2+2H2O�T4Fe��OH��3 �� ��Ҫʵ��Fe��OH��3��FeCl2��ת����Ӧ�ü��뻹ԭ�Ե�������ᣨ��HI��������RΪ����HI��Fe��OH��3��Ӧ����Ӧ�����ӷ���ʽΪ2Fe��OH��3+6H++2I���T2Fe2++I2+6H2O�����Դ��ǣ�2Fe3++Fe�T3Fe2+��4Fe��OH��2+O2+2H2O�T4Fe��OH��3������ᣨ��HI����2Fe��OH��3+6H++2I���T2Fe2++I2+6H2O����3����A��E��Ϊ�����A�ǵ���ɫ���壻B��C����Һ�ڵ����ʵ���Ũ��ʱ��C ��Һ��pH��С�����D��ˮ��Һ������Ҫ�Ĺ�ҵ����֮һ��D��E��CҲ�ǹ�ҵ�Ʊ�C���ձ鷽����������ʷֱ���A ΪNa2O2��BΪNaOH��CΪNa2CO3��D ΪNaCl��EΪNaHCO3 �� YΪNa����Na�����ʵ���Ϊx��K�����ʵ���Ϊy���������غ�23x+39y=5.05���ɵ�ʧ�����غ�x+y=0.075��2����֪x=0.05��y=0.1�����Ի�ѧʽΪNaK2 �� ���Դ��ǣ�NaK2 ��
CO2��+2SO2��+2H2O����A��C�ķ�ӦΪS��g��+O2��g���TSO2��g����ÿת��1mol e���ͻ����143.5kJ����ת��4mol��������143.5kJ��4=574.0kJ��������Ӧ���Ȼ�ѧ����ʽΪS��g��+O2��g���TSO2��g����H=��574.0 kJ/mol�����Դ��ǣ�S��g��+O2��g���TSO2��g����H=��574.0 kJ/mol����2����AΪ���ʣ�B��C���������࣬D��һ�ְ�ɫ��������B��ˮ��Һ�����ԣ�C��ˮ��Һ�ʼ��ԣ�����ת����ϵ��֪AΪAl��BΪAlCl3 �� CΪNaAlO2 �� DΪAl��OH��3 �� B��Һ�����Ե�ԭ����������ˮ��ʹ��Һ�����ԣ����ӷ���ʽΪAl3++3H2OAl��OH��3+3H+ �� ���Դ��ǣ�Al3++3H2OAl��OH��3+3H+������B��Һ�ʻ�ɫ���뱽����Һ��Ϻ�����ɫ����˵��B�к���Fe3+ �� AӦΪFe��C�к���Fe2+ �� E��һ�ֲ����Լ��ת����ϵ��֪DΪFe��OH��2 �� EΪFe��OH��3 �� B��C�����ӷ���ʽΪ2Fe3++Fe�T3Fe2+ �� D��E�Ļ�ѧ����ʽΪ4Fe��OH��2+O2+2H2O�T4Fe��OH��3 �� ��Ҫʵ��Fe��OH��3��FeCl2��ת����Ӧ�ü��뻹ԭ�Ե�������ᣨ��HI��������RΪ����HI��Fe��OH��3��Ӧ����Ӧ�����ӷ���ʽΪ2Fe��OH��3+6H++2I���T2Fe2++I2+6H2O�����Դ��ǣ�2Fe3++Fe�T3Fe2+��4Fe��OH��2+O2+2H2O�T4Fe��OH��3������ᣨ��HI����2Fe��OH��3+6H++2I���T2Fe2++I2+6H2O����3����A��E��Ϊ�����A�ǵ���ɫ���壻B��C����Һ�ڵ����ʵ���Ũ��ʱ��C ��Һ��pH��С�����D��ˮ��Һ������Ҫ�Ĺ�ҵ����֮һ��D��E��CҲ�ǹ�ҵ�Ʊ�C���ձ鷽����������ʷֱ���A ΪNa2O2��BΪNaOH��CΪNa2CO3��D ΪNaCl��EΪNaHCO3 �� YΪNa����Na�����ʵ���Ϊx��K�����ʵ���Ϊy���������غ�23x+39y=5.05���ɵ�ʧ�����غ�x+y=0.075��2����֪x=0.05��y=0.1�����Ի�ѧʽΪNaK2 �� ���Դ��ǣ�NaK2 ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ�����и������ʣ����ܰ� ![]() (��������ʾ��Ӧһ�����)��ϵת�������� ��
(��������ʾ��Ӧһ�����)��ϵת�������� ��
ѡ�� | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | NaOH | NaHCO3 | Na2CO3 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D



