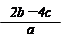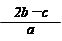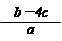题目内容
(7分) 向27.2Cu和Cu2O的混合物中加入某浓度的稀HNO3500mL,固体完全溶解后在所得溶液中加入1mol/L 的NaOH溶液1L使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g.
请列式计算:
(1)Cu与Cu2O 的物质的量之比 (2)HNO3的物质的量浓度
请列式计算:
(1)Cu与Cu2O 的物质的量之比 (2)HNO3的物质的量浓度
(7分) (1)2:1 (2)2.4mol/L
试题分析:设Cu与Cu2O 的物质的量分别是x和y,则64x+144y=27.2。根据铜原子守恒可知,(x+2y)×98=39.2,解得x=0.2mol,y=0.1mol。
(2)溶液呈中性,所以溶液恰好是硝酸钠溶液,则根据钠原子守恒可知,硝酸钠的物质的量是1mol/L×1L=1mol。0.1mol氧化亚铜失去0.2mol电子,0.2mol铜失去0.4mol电子,所以根据电子的得失守恒可知,被还原的硝酸是0.6mol÷3=0.2mol,则原硝酸的物质的量是1.2mol÷0.5L=2.4mol/L。
点评:在根据方程式进行的有关计算时,应该注意利用好各种守恒法,例如质量守、电荷守恒以及得失电子守恒等。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目