题目内容
下列反应的离子方程式书写正确的是
| A.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
B.Fe(OH)3胶体的制备:Fe3++3H2O Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| C.向明矾溶液中滴加少量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-=2Al (OH)3↓+3 BaSO4↓ |
| D.用过量氨水吸收工业尾气中的SO2:NH3·H2O+SO2=NH4++HSO3- |
C
解析试题分析:A、应为:2H++SO42-+Ba2++2OH-=BaSO4↓+H2O,错误;B、应为:Fe3++3H2O Fe(OH)3(胶体)+3H+,错误;C、正确;D、应为:2NH3·H2O+SO2=2NH4++SO32-+2 H2O,错误。
Fe(OH)3(胶体)+3H+,错误;C、正确;D、应为:2NH3·H2O+SO2=2NH4++SO32-+2 H2O,错误。
考点:考查离子方程式的书写。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
室温下,强酸性和强碱性溶液中都不能共存的离子组是
| A.Ba2+、Fe2+、NO3-、I- | B.K+、Na+、SO32-、S2- |
| C.K+、Na+、AlO2-、SO42- | D.NH4+、Cu2+、Cl-、NO3- |
能正确表示下列反应的离子方程式是
A.向0.1mol/L的Na2S溶液中加入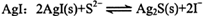 |
B.碳酸钠溶液显碱性的原因: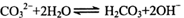 |
C.二氧化硫通入氯化铁溶液: |
D.用醋酸清洗盛放石灰水试剂瓶内壁出现的白色固体: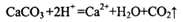 |
常温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A.氨水中:NH4+、Fe2+、SO42-、HSO3- |
| B.pH=l的溶液中:、Mg2+、Fe3+、Cl-、NO3- |
| C.通入足量CO2的溶液中:Ca2+、Na+、SiO32-、CO32- |
| D.由水电离出的c(OH-)=1×10—12mol·L—1的溶液中:NH4+、HCO3-、Na+、Cl- |
在下述条件下,一定能大量共存的离子组是
| A.无色透明的水溶液中:K+、Ba2+、I-、MnO4- |
| B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ |
| C.能与Al反应产生H2的溶液中:HCO3-、Na+、Al3+、Br- |
| D.常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
下列离子方程式正确的是( )
A.小苏打溶液中加入少量石灰水:HCO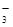 +Ca2++OH-=CaCO3↓+H2O +Ca2++OH-=CaCO3↓+H2O |
B.稀硝酸中加入过量铁粉: Fe+4H++NO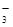 =Fe3++NO↑+2H2O =Fe3++NO↑+2H2O |
| C.溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
D.苯酚钠溶液中通入少量二氧化碳: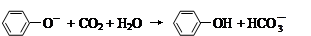 |
下列各组离子在溶液中可以大量共存的是
| A.Ag+、NO3-、Cl-、Na+ | B.Na+、Ba2+、Mg2+、NO3- |
| C.OH-、K+、HCO3-、Ba2+ | D.H+、CO32-、K+、Ca2+ |
在下列溶液中,各组离子一定能够大量共存的是
| A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+ |
| B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C.由水电离出的c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br- |
| D.与铝作用能产生氢气的溶液:Al3+、K+、SO42-、CO32- |
下列离子方程式书写正确的是
| A.等物质的量的 CO2与氢氧化钠溶液反应:CO2+2OH-=CO32-+H2O |
| B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C.氢氧化钙溶液与等物质的量的稀H2SO4混合:Ca2++OH-+H++SO42- =CaSO4↓+H2O |
D.用石墨电极电解饱和食盐水:2H2O+2Cl- Cl2↑+H2↑+ 2OH- Cl2↑+H2↑+ 2OH- |