题目内容
[有机化学基础]2006年5月14日某新闻媒体报道齐齐哈尔第二制药有限公司生产的假药事件,“齐二药”违反规定,购入工业用“二甘醇”代替医用丙二醇(C3H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇,造成多名患者死亡.二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,其主要产品有吗啉及其衍生物1,4-二恶烷______等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛.二甘醇一般的合成路线为:
请回答下列问题:
(1)下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程Ⅰ是石油加工中常用步骤,其名称为______.
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,则为了能得到二甘醇D,物质B到物质C的反应条件是______,该反应属于______(添反应类型).写出B可能生成E的化学方程式:______
【答案】分析:(1)A、丙二醇与乙二醇含有相同的官能团-OH,且数目相同,其它为单键,组成通式相同;
B、二甘醇除含有2个-OH,还含有醚键,与丙二醇、乙二醇含有的官能团不同;
C、丙二醇可以氧化物为草酸,二甘醇氧化物HOOCHCH2-O-CH2CHO0H;
D、分液可以分离互不相溶的液体,丙二醇与二甘醇互溶;
(2)由石油裂解生成乙烯;
(3)BrCH2CH2Br在氢氧化钠水溶液、加热下发生取代反应生成HOCH2CH2OH,如果条件控制不好会发生消去反应生成乙炔,可用于金属的切割;
(4)由二甘醇的合成路线可知,A为C2H2,B为BrCH2CH2Br,C为HOCH2CH2OH,D为HOCH2CH2-O-CH2CH2OH,
(5)反应Ⅲ是乙二醇在浓硫酸、加热条件下发生分子间脱水生成HOCH2CH2-O-CH2CH2OH;
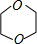
(6)二甘醇在浓硫酸、加热条件下发生脱水反应生成1,4-二恶烷( ).
).
解答:解:(1)A、丙二醇与乙二醇含有相同的官能团-OH,且数目相同,其它为单键,组成通式相同,故A正确;
B、二甘醇除含有2个-OH,还含有醚键,与丙二醇、乙二醇含有的官能团不同,故B错误;
C、丙二醇可以氧化物为草酸,二甘醇氧化物HOOCHCH2-O-CH2CHO0H,故C错误;
D、丙二醇与二甘醇互溶,不能利用分液方法分离,故D错误;
故选A;
(2)由石油裂解生成乙烯,故答案为:裂解;
(3)BrCH2CH2Br在氢氧化钠水溶液、加热下发生取代反应生成HOCH2CH2OH,如果条件控制不好会发生消去反应生成乙炔,反应方程式为:CH2BrCH2Br+2NaOH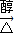 HC≡CH↑+2 NaBr,
HC≡CH↑+2 NaBr,
故答案为:氢氧化钠水溶液、加热,取代反应,CH2BrCH2Br+2NaOH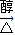 HC≡CH↑+2 NaBr;
HC≡CH↑+2 NaBr;
(4)由二甘醇的合成路线可知,A为C2H2,B为BrCH2CH2Br,C为HOCH2CH2OH,D为HOCH2CH2-O-CH2CH2OH,
故答案为:C2H2,BrCH2CH2Br,HOCH2CH2OH,;
(5)反应Ⅲ是乙二醇在浓硫酸、加热条件下发生分子间脱水生成HOCH2CH2-O-CH2CH2OH,反应方程式为:2HO-CH2-CH2-OH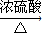 2HO-CH2-CH2-O-CH2-CH2-OH+H2O,
2HO-CH2-CH2-O-CH2-CH2-OH+H2O,
故答案为:2HO-CH2-CH2-OH 2HO-CH2-CH2-O-CH2-CH2-OH+H2O;
2HO-CH2-CH2-O-CH2-CH2-OH+H2O;
(6)二甘醇在浓硫酸、加热条件下发生脱水反应生成1,4-二恶烷(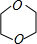 ),反应方程式为:HO-CH2-CH2-O-CH2-CH2-OH
),反应方程式为:HO-CH2-CH2-O-CH2-CH2-OH
 +H2O,
+H2O,
故答案为:HO-CH2-CH2-O-CH2-CH2-OH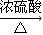
 +H2O.
+H2O.
点评:本题涉及到石油的裂解、有机反应类型、有机反应条件的选择以及烯与卤代烃、醇的性质与转化等,难度中等,注意基础知识的掌握.
B、二甘醇除含有2个-OH,还含有醚键,与丙二醇、乙二醇含有的官能团不同;
C、丙二醇可以氧化物为草酸,二甘醇氧化物HOOCHCH2-O-CH2CHO0H;
D、分液可以分离互不相溶的液体,丙二醇与二甘醇互溶;
(2)由石油裂解生成乙烯;
(3)BrCH2CH2Br在氢氧化钠水溶液、加热下发生取代反应生成HOCH2CH2OH,如果条件控制不好会发生消去反应生成乙炔,可用于金属的切割;
(4)由二甘醇的合成路线可知,A为C2H2,B为BrCH2CH2Br,C为HOCH2CH2OH,D为HOCH2CH2-O-CH2CH2OH,
(5)反应Ⅲ是乙二醇在浓硫酸、加热条件下发生分子间脱水生成HOCH2CH2-O-CH2CH2OH;
(6)二甘醇在浓硫酸、加热条件下发生脱水反应生成1,4-二恶烷(
 ).
).解答:解:(1)A、丙二醇与乙二醇含有相同的官能团-OH,且数目相同,其它为单键,组成通式相同,故A正确;
B、二甘醇除含有2个-OH,还含有醚键,与丙二醇、乙二醇含有的官能团不同,故B错误;
C、丙二醇可以氧化物为草酸,二甘醇氧化物HOOCHCH2-O-CH2CHO0H,故C错误;
D、丙二醇与二甘醇互溶,不能利用分液方法分离,故D错误;
故选A;
(2)由石油裂解生成乙烯,故答案为:裂解;
(3)BrCH2CH2Br在氢氧化钠水溶液、加热下发生取代反应生成HOCH2CH2OH,如果条件控制不好会发生消去反应生成乙炔,反应方程式为:CH2BrCH2Br+2NaOH
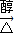 HC≡CH↑+2 NaBr,
HC≡CH↑+2 NaBr,故答案为:氢氧化钠水溶液、加热,取代反应,CH2BrCH2Br+2NaOH
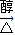 HC≡CH↑+2 NaBr;
HC≡CH↑+2 NaBr;(4)由二甘醇的合成路线可知,A为C2H2,B为BrCH2CH2Br,C为HOCH2CH2OH,D为HOCH2CH2-O-CH2CH2OH,
故答案为:C2H2,BrCH2CH2Br,HOCH2CH2OH,;
(5)反应Ⅲ是乙二醇在浓硫酸、加热条件下发生分子间脱水生成HOCH2CH2-O-CH2CH2OH,反应方程式为:2HO-CH2-CH2-OH
 2HO-CH2-CH2-O-CH2-CH2-OH+H2O,
2HO-CH2-CH2-O-CH2-CH2-OH+H2O,故答案为:2HO-CH2-CH2-OH
 2HO-CH2-CH2-O-CH2-CH2-OH+H2O;
2HO-CH2-CH2-O-CH2-CH2-OH+H2O;(6)二甘醇在浓硫酸、加热条件下发生脱水反应生成1,4-二恶烷(
 ),反应方程式为:HO-CH2-CH2-O-CH2-CH2-OH
),反应方程式为:HO-CH2-CH2-O-CH2-CH2-OH
 +H2O,
+H2O,故答案为:HO-CH2-CH2-O-CH2-CH2-OH

 +H2O.
+H2O.点评:本题涉及到石油的裂解、有机反应类型、有机反应条件的选择以及烯与卤代烃、醇的性质与转化等,难度中等,注意基础知识的掌握.

练习册系列答案
相关题目



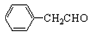 的不饱和度为____________。
的不饱和度为____________。 的系统命名为__________________。
的系统命名为__________________。