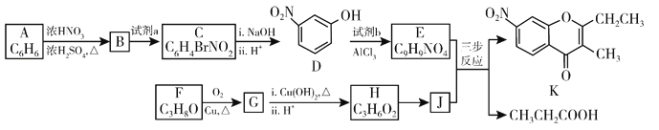
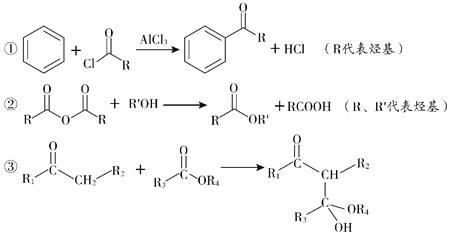
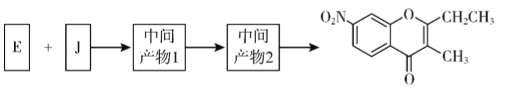
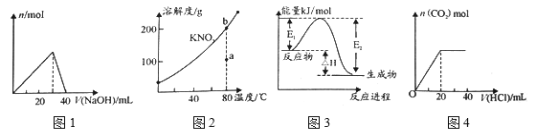
题目内容
【题目】五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期;C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙;A原子的最外层电子数比次外层电子数多3个;D周期序数等于D原子最外层电子数;E原子半径是同周期中最小的(除稀有气体外),根据以上信息回答下列问题:
(1)A元素在周期表中的位置__________________;
(2)乙物质中存在的化学键类型是______________;
(3)写出C与D的最高价氧化物对应的水化物相互间反应的离子方程式_____________;
(4)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的有效成分的电子式为_______________.
【答案】第2周期第VA族 离子键、共价键 Al(OH)3+OH﹣═AlO2﹣+2H2O ![]()
【解析】
由“A原子的最外层电子数比次外层电子数多3个”可知A为N元素;D在第三周期,依据“D周期序数等于其原子最外层电子数”确定D为Al元素;E原子半径为第三周期中最小(稀有气体除外),E为氯元素;C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,B和C分别为氧元素和钠元素,甲为Na2O、乙为Na2O2。
(1)A元素是氮元素,位于元素周期表中的第2周期第VA族;
(2)乙物质为Na2O2,其中存在的化学键类型是离子键和(非极性)共价键;
(3)C的最高价氧化物的水化物为NaOH,D的最高价氧化物对应的水化物为Al(OH)3,两者发生反应的离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O;
(4)E的单质为氯气,C的最高价氧化物对应的水化物为NaOH,二者发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,其中NaClO是“84”消毒液的有效成分之一,其电子式为![]() 。
。

 轻松课堂标准练系列答案
轻松课堂标准练系列答案