题目内容
【题目】Ⅰ.某实验小组为探究ClO-、I2、SO![]() 在酸性条件下的氧化性强弱,设计实验如下:
在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:__________________________。
(2)实验②的化学反应中转移电子的物质的量是___________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO![]() 的氧化性由弱到强的顺序是________________。
的氧化性由弱到强的顺序是________________。
Ⅱ.(4)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_______________________(用离子方程式表示)。
【答案】 ClO-+2I-+2H+===I2+Cl-+H2O 0.004 mol SO![]() <I2<ClO- C ClO-+Cl-+2H+===Cl2↑+H2O
<I2<ClO- C ClO-+Cl-+2H+===Cl2↑+H2O
【解析】Ⅰ.(1)实验①说明酸性条件下,次氯酸钠把碘离子氧化生成碘单质,同时自身被还原生成氯离子,该反应中,次氯酸根离子得电子作氧化剂,碘离子失电子是还原剂,氧化产物是碘,所以氧化性强弱为:ClO->I2,反应离子方程式为:ClO-+2I-+2H+=I2+Cl-+H2O,故答案为:ClO-+2I-+2H+=I2+Cl-+H2O;(2)实验②说明碘单质把亚硫酸根离子氧化生成硫酸根离子,自身被还原生成碘离子,氧化剂是碘,还原剂是亚硫酸钠,氧化产物是硫酸根离子,所以氧化性强弱为:I2>SO42-,反应离子方程式为:H2O+I2+SO32-=SO42-+2I-+2H+,设转移电子的物质的量为x.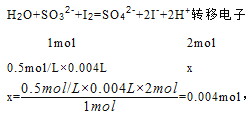
答:转移电子的物质的量是0.004mol;
(3)实验①说明氧化性强弱为:ClO->I2,实验②说明氧化性强弱为:I2>SO42-,所以在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是SO42-、I2、ClO-,故答案为:SO42-、I2、ClO-.
Ⅱ.(4)1mol Cl2(发生的反应为Cl2+H2O=HCl+HClO)、H2O2、ClO2、O3分别消毒时,转移电子依次为1mol、1mol、5mol、2mol,等物质的量的上述物质反应,ClO2转移的电子数最多,消毒效率最高,故答案为:C;(5)ClO-与浓盐酸中的Cl-会发生反应生成有毒的Cl2,方程式为ClO-+Cl-+2H+═Cl2↑+H2O。

 名校课堂系列答案
名校课堂系列答案