��Ŀ����
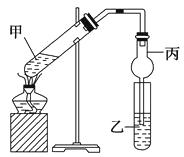
����Ŀ����ҵ�ϲ��õ�һ����ˮ�����������£�������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3 �� Fe��OH��3���������ԣ�����������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���ø�ԭ��������ˮ�����װ����ͼ��ʾ������˵����ȷ���ǣ�������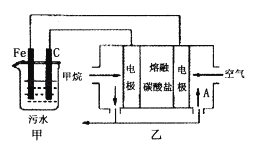
A.Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ��ѭ��������AΪCO2
B.��װ���������ķ�ӦΪFe��2e���TFe2+
C.Ϊ��������ˮ�ĵ���������Ӧ����ˮ������������NaOH��Һ
D.����װ������1.6 g CH4�μӷ�Ӧ����C�缫���������������ڱ�״����Ϊ4.48 L
���𰸡�A
���������⣺A�������������̼����Ϊ����ʣ�����ѭ�����õ�����ֻ�ж�����̼��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���ع���ʱ���� �в���A���ʲμ�ѭ����A������CO2 �� ��A��ȷ��
B��CΪ�����������������ӵõ����������������װ���������ķ�ӦΪ2H++2e��=H2������B����
C��������ˮ��pH��5.0��6.0֮�䣬��NaOH��ʹ��Һ��pH���C����
D������װ������1.6 g ��0.1molCH4�μӷ�Ӧ���ɵ缫����ʽCH4+4CO32����8e��=5CO2+2H2O��֪ת�Ƶ���Ϊ0.8mol�����ʱ������ӦʽΪ2H++2e��=H2���������ɵ�����Ϊ0.4mol�����������ڱ�״����Ϊ8.96 L����D����
��ѡA��

 ��У����ϵ�д�
��У����ϵ�д�