题目内容
【题目】人类历史上,硅及其化合物的应用由来已久。请回答下列问题。
(1)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

已知:反应②的反应为Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
上述反应①-④中,属于置换反应的是______________________________;反应③中发生主要反应的化学方程式为_____________________________________;该工艺中可循环使用的物质为______________________________(填化学式)。
(2)用石英砂和焦炭在电弧炉中高温加热也可以得到无机材料碳化硅。请写出制备碳化硅反应的化学方程式为________________________________________;碳化硅属于晶体___________。(填晶体类型)
(3)氮化硅是一种耐高温材料,粉末状氮化硅可以由SiCl4的蒸气和NH3反应制取。请问:
①氮化硅的化学式为______________________________。
②由SiCl4和NH3反应制取氮化硅的化学方程式为________________________________________。
【答案】 ①②③ SiHCl3+H2![]() Si+3HCl HCl,H2 SiO2+3C
Si+3HCl HCl,H2 SiO2+3C![]() SiC+2CO↑ 原子晶体 Si3N4 3SiCl4+4NH3
SiC+2CO↑ 原子晶体 Si3N4 3SiCl4+4NH3![]() Si3N4+12HCl
Si3N4+12HCl
【解析】(1)反应①为2C+SiO2![]() 2CO+Si,反应②为Si+3HCl
2CO+Si,反应②为Si+3HCl![]() SiHCl3+H2,反应③为SiHCl3+H2
SiHCl3+H2,反应③为SiHCl3+H2![]() Si+3HCl,反应④为CO+H2O
Si+3HCl,反应④为CO+H2O![]() CO2+H2,则反应①-④中,属于置换反应的是①②③;反应③中发生主要反应的化学方程式为SiHCl3+H2
CO2+H2,则反应①-④中,属于置换反应的是①②③;反应③中发生主要反应的化学方程式为SiHCl3+H2![]() Si+3HCl;结合工业流程,可知该工艺中可循环使用的物质为HCl,H2;
Si+3HCl;结合工业流程,可知该工艺中可循环使用的物质为HCl,H2;
(2)石英砂和焦炭在电弧炉中高温加热生成碳化硅,发生反应的化学方程式为SiO2+3C![]() SiC+2CO↑;碳化硅是新型无机非金属材料,属于原子晶体;
SiC+2CO↑;碳化硅是新型无机非金属材料,属于原子晶体;
(3)氮化硅是一种耐高温材料,粉末状氮化硅可以由SiCl4的蒸气和NH3反应制取。请问:
①N的非金属性比Si强,则N为-3价,Si为+4价,氮化硅的化学式为Si3N4;
②由SiCl4和NH3反应制取氮化硅的化学方程式为3SiCl4+4NH3![]() Si3N4+12HCl。
Si3N4+12HCl。

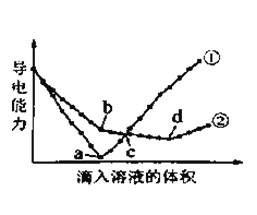
【题目】苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸(C6H5COOH)和甲醇为原料制备苯甲酸甲酯。有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度(g/cm3) | 水溶性 | |
苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。
回答下列问题:
(1)该反应的化学方程式为__________,该反应的原子利用率是_______。
己知:原子利用率=(预期产物的总质量/全部反应物的总质量)×100%
(2)实验中,应选择(如下图)_____(填序号)作为冷凝回流装置,该仪器的名称为______。

(3)使用过量甲醇的原因是__________。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制。

(4)饱和碳酸钠溶液的作用是________,操作a的名称为________。
(5)由于有机层和水层的密度比较接近,兴趣小组的同学无法直接判断有机层在上层还是下层,请你设计简单易行的方案,简述实验方法,可能的现象及结论__________。
(6)该实验中制得苯甲酸甲酯8.30g,则苯甲酸甲酯的产率为________。
【题目】某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应。实验步骤及现象如下:
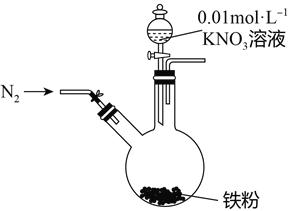
实验步骤 | 实验现象 |
1、打开弹簧夹,缓慢通入N2 | |
2、加入pH为2.5的0.01mol/L酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色; 铁粉不再溶解后,剩余铁粉表面出现少量白色物质附着。 |
3、反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化。 |
4、将剩余固体过滤 | 表面的白色物质变为红褐色。 |
(1)通入N2并保持后续反应均在N2氛围中进行的实验目的是______________________________。
(2)白色物质是__________,用化学方程式解释其变为红褐色的原因:____________________。
(3)为了探宄滤液的成分,该同学进一步设计了下述实验:
实验步骤 | 实验现象 |
1、取部分滤液于试管中,向其中加入KSCN溶液 | 溶液液无变化 |
2、将上述溶液分为两份,一份中滴入氯气;另一份中滴加稀硫酸 | 两份溶液均变为红色 |
3、另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸。 | 有气体生成,该气体使红色石蕊试纸变蓝。 |
(i)根据以上实验现象,可以判断滤液中存在____________________离子。
(ii)步骤2中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因____________________。