题目内容
FeS2在空气中充分燃烧的化学方程式为4FeS2+11O2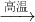 2Fe2O3+8SO2,若a g FeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
2Fe2O3+8SO2,若a g FeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
- A.120N/a
- B.120a/11N
- C.11a/120N
- D.120N/11a
D
分析:反应中Fe元素化合价由+2升高为+3价,S原子化合价由-1价升高为+4价,氧元素化合价由0价降低为-2价,根据n= 计算a g FeS2的物质的量,再根据方程式计算参加反应的氧气的物质的量,计算转移电子物质的量n,根据N=nNA计算阿伏伽德罗常数.
计算a g FeS2的物质的量,再根据方程式计算参加反应的氧气的物质的量,计算转移电子物质的量n,根据N=nNA计算阿伏伽德罗常数.
解答:agFeS2的物质的量为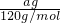 =
=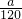 mol,由方程式4FeS2+11O2
mol,由方程式4FeS2+11O2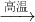 2Fe2O3+8SO2可知,参加反应的氧气的物质的量为
2Fe2O3+8SO2可知,参加反应的氧气的物质的量为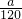 mol×
mol×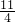 =
=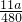 mol,反应中氧元素化合价由0价降低为-2价,故转移电子物质的量为
mol,反应中氧元素化合价由0价降低为-2价,故转移电子物质的量为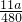 mol×2×2=
mol×2×2=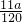 mol,所以N=
mol,所以N=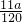 mol×NA,故NA=
mol×NA,故NA=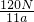 mol-1,
mol-1,
故选D.
点评:本题考查氧化还原反应的有关计算、阿伏伽德罗常数等,难度不大,注意基础知识的理解掌握.
分析:反应中Fe元素化合价由+2升高为+3价,S原子化合价由-1价升高为+4价,氧元素化合价由0价降低为-2价,根据n=
 计算a g FeS2的物质的量,再根据方程式计算参加反应的氧气的物质的量,计算转移电子物质的量n,根据N=nNA计算阿伏伽德罗常数.
计算a g FeS2的物质的量,再根据方程式计算参加反应的氧气的物质的量,计算转移电子物质的量n,根据N=nNA计算阿伏伽德罗常数.解答:agFeS2的物质的量为
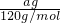 =
=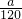 mol,由方程式4FeS2+11O2
mol,由方程式4FeS2+11O2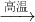 2Fe2O3+8SO2可知,参加反应的氧气的物质的量为
2Fe2O3+8SO2可知,参加反应的氧气的物质的量为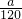 mol×
mol×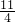 =
=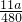 mol,反应中氧元素化合价由0价降低为-2价,故转移电子物质的量为
mol,反应中氧元素化合价由0价降低为-2价,故转移电子物质的量为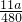 mol×2×2=
mol×2×2=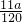 mol,所以N=
mol,所以N=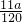 mol×NA,故NA=
mol×NA,故NA=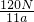 mol-1,
mol-1,故选D.
点评:本题考查氧化还原反应的有关计算、阿伏伽德罗常数等,难度不大,注意基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2Fe2O3
+ 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
2Fe2O3
+ 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为  2Fe2O3+8SO2,若a g FeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为( )
2Fe2O3+8SO2,若a g FeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为( )