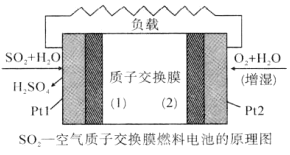
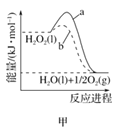
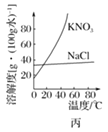
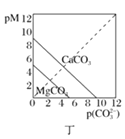
题目内容
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如图:

(1)加快“浸取”速率除将辉铜矿粉碎外,还可采取的措施有_________ (任写一种);研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是________。
(2)滤渣I中的主要成分是MnO2、S、SiO2。请写出“浸取”反应中生成S的化学方程式:________。
(3)常温下“除铁”时加入的试剂A可用____________较为合适,若加A后溶液的pH调为5,则溶液中Fe3+ 的浓度为______mol/L。{Ksp[Fe(OH)3]=4.0×10- 38}
(4)写出“沉锰"(除Mn2+ )过程中反应的离子方程式:______。
(5)“赶氨”时,最适宜的操作方法是__________。
(6)滤液II经蒸发结晶得到的盐主要是________(写化学式)。
【答案】适当提高硫酸的浓度或适当加热或充分搅拌 Fe3+可催化Cu2S被MnO2氧化 2MnO2+Cu2S+4H2SO4=S↓+ 2CuSO4+2MnSO4+4H2O CuO ![]() Mn2++HCO3-+NH3=MnCO3↓+NH4+ 将溶液加热 (NH4)2SO4
Mn2++HCO3-+NH3=MnCO3↓+NH4+ 将溶液加热 (NH4)2SO4
【解析】
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为为二氧化锰、二氧化硅和单质硫,滤液中含有铁离子、锰离子和铜离子,调节溶液pH除去铁离子,加入碳酸氢铵溶液沉淀锰,过滤得到滤液,赶出氨气循环使用,得到碱式碳酸铜。
(1)加快“浸取”速率除将辉铜矿粉碎外,还可以适当提高硫酸的浓度、适当加热、充分搅拌等,浸取时,Fe2O3和稀硫酸反应生成硫酸铁和水,Fe2O3起媒介作用,Fe3+可催化Cu2S被MnO2氧化,若先除铁再浸取,浸取速率明显变慢,故答案为:适当提高硫酸的浓度或适当加热或充分搅拌;Fe3+可催化Cu2S被MnO2氧化;
(2)滤渣I中的主要成分是MnO2、S、SiO2。“浸取”反应中生成S的化学方程式为:2MnO2+Cu2S+4H2SO4=S↓+ 2CuSO4+2MnSO4+4H2O,故答案为:2MnO2+Cu2S+4H2SO4=S↓+ 2CuSO4+2MnSO4+4H2O;
(3)常温下“除铁”时加入的试剂A可用CuO较为合适,已知Ksp[Fe(OH)3]=4.0×10- 38,pH=5,则c(H+)=10-5,c(OH-)=10-9,Ksp[Fe(OH)3]=![]() 4.0×10- 38,
4.0×10- 38,![]() mol/L,故答案为:CuO;
mol/L,故答案为:CuO;![]() ;
;
(4)“沉锰"过程中加入碳酸氢铵和氨气,生成碳酸锰,其离子方程式为:Mn2++HCO3-+NH3=MnCO3↓+NH4+,故答案为:Mn2++HCO3-+NH3=MnCO3↓+NH4+;
(5)“赶氨”时,最适宜的操作方法是减小氨气溶解度,氨气是易挥发性气体,加热驱赶,故答案为:将溶液加热;
(6)滤液II主要是硫酸铵溶液,通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸铵晶体,故答案为:(NH4)2SO4。

【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。某实验兴趣小组将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl![]() 2FeCl2 +C6H4Cl2+HC1↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2。按照如图装置:
2FeCl2 +C6H4Cl2+HC1↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2。按照如图装置:
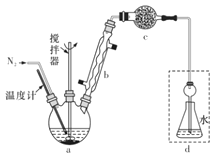
在三颈烧瓶中放入162.5g无水FeCl3与225 g氯苯,控制反应温度在130℃下加热3 h,冷却、过滤,洗涤、干燥得到粗产品。有关数据如表:
C6H5Cl | C6H4Cl2 | AgCl | Ag2CrO4 | |
颜色 | — | — | 白色 | 砖红色 |
溶度积 | — | — | 1.56×10-10 | 9×10-12 |
熔点/℃ | -45 | 53 | — | — |
沸点/℃ | 132 | 173 | — | — |
回答下列问题:
(1)仪器c的名称是_______,盛装的试剂可以是_______________(填字母代号)。
A.碱石灰 B,浓硫酸 C.无水氯化钙 D.固体氢氧化钠
(2)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是______(填字母代号)。
e.  f.
f.  g.
g.  h.
h. 
(3)如何从滤液中回收过量的氯苯:__________。
(4)将锥形瓶内的溶液稀释至1 000 mL,从中取出10. 00 mL,滴加几滴K2CrO4 作指示剂,用0. 200 0 mol/L AgNO3溶液进行滴定,当达到终点时平均消耗22. 50 mL AgNO3溶液。
①滴定终点的现象是________,使用棕色滴定管进行滴定的目的是_________。
②无水FeCl3的转化率α=_______
③上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏________(填“高”或“低”)。