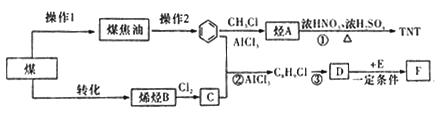
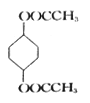
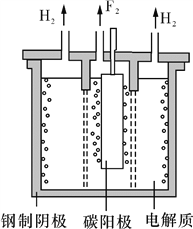
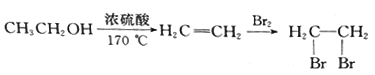题目内容
【题目】甲醇(CH3OH)是一种重要的化工原料,既可用于化工生产,也可直接用做燃料。
(1)工业上可用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,CO2和H2反应生成甲醇和水,当消耗2molCO2时放出98kJ的热量,该反应的热化学方程式为___________。
(2)甲醇也可由CO与H2反应制得。在一定温度下,初始容积相同的两个容器中(如图),发生反应: CO(g)+2H2(g)=CH30H(g)。
① 能表明甲和乙容器中反应一定达到平衡状态的是________(填字母代号)。
A.混合气体的密度保持不变 B.混合气体的总压强保持不变
C.CO的质量分数保持不变 D. CO 与H2的转化率之比为3 : 2
E.v(CO)=v(CH30H)
②两容器中反应达到平衡时,Co的转化率α甲______α乙(填“>”、“< ”或“=”)
(3)组成n(H2)/n(CO+CO2)=2.60时,体系中CO 的平衡转化率(α)动与温度和压强的关系如图所示。图中的压强由大到小依次为_______,其判断理由是______________。
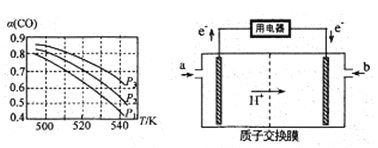
(4)甲醇燃料电池(简称DMFC)可作为常规能源的替代品而备受关注。DMFC的工作原理如图所示:
① 加入a 物质的电极是电池的______(填“正”或“负”)极,其电极反应式为________.
② 常温下以该装置作电源,用惰性电极电解NaCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,两电极均得到0.14mol的气体。若电解后溶液体积为4OL,则电解后溶液的pH 为________。
【答案】 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49 kJ/mol C > P3>P2>P1 该反应为气体分子数减小的反应,在相同温度下,加压有利于提升CO的转化率 负 CH3OH+H2O
CH3OH(g)+H2O(g) ΔH=-49 kJ/mol C > P3>P2>P1 该反应为气体分子数减小的反应,在相同温度下,加压有利于提升CO的转化率 负 CH3OH+H2O![]() CO2+6H+ 11
CO2+6H+ 11
【解析】本题分析:本题主要考查化学平衡。
(1)在2×105Pa、300℃的条件下,CO2和H2反应生成甲醇和水,当消耗2molCO2时放出98kJ的热量,该反应的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49 kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49 kJ/mol。
(2)① A.乙中混合气体的密度始终保持不变;B.甲中混合气体的总压强始终保持不变;C.CO的质量分数随着反应进行而变化,当保持不变时说明反应达到平衡状态;D. CO 与H2的转化率之比与平衡状态之间没有一定关系;E.都是正反应速率,不能说明反应达到平衡状态。故选C。
②该反应气体物质的量减少,甲相当于乙加压而成,加压平衡右移,两容器中反应达到平衡时,CO的转化率α甲>α乙。
(3) 图中的压强由大到小依次为P3>P2>P1,其判断理由是该反应为气体分子数减小的反应,在相同温度下,加压有利于提升CO的转化率。
(4)① 从电子移动方向可知,加入a 物质的电极是电池的负极,其电极反应式为CH3OH+H2O-6e-=CO2+6H+。
② 阴极首先生成铜,之后生成氢气和氢氧化钠 ,产生0.14mol氢气同时产生0.28molOH-。阳极产生氯气、氧气和硫酸,根据题意可得n(Cl2)+ n(O2)=0.14mol和2n(Cl2)+ 4n(O2)=0.40mol,解得 n(O2)=0.06mol,同时生成0.24molH+。电解后剩余0.04molOH-,溶液体积为4OL,则c(OH-)=1×10-3mol/L, c(H+)= 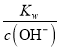 =
=![]() -mol/L =1×10-11mol/L,溶液的pH=11.
-mol/L =1×10-11mol/L,溶液的pH=11.

【题目】硫酰氯(SO2Cl2)常作氯化剂或氯璜化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的化学方程式为SO2(g)+Cl2(g) ![]() SO2Cl2(l)
SO2Cl2(l)
△H=-97.3kJ/mol。装置如图所示(夹持仪器已省略),请回答有关问题:
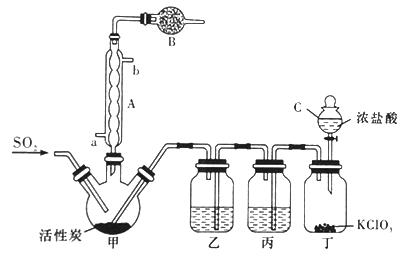
(1)仪器C的名称为___________________。
(2)仪器B的作用是_____________________。
(3)装置丙的作用为____________,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为___________________。
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是___________________。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、紫色石蕊溶液)__________________________。