题目内容
【题目】按要求填空:
(1)0.2molO3和0.3molO2的质量(选填“相等”、“不相等”或“无法判断”),分子数之比为 , 所含原子数之比为 , 在相同条件下的体积之比为。
(2)73gHCl气体中含有个分子,标准状况下占有的体积为L。
(3)相同物质的量浓度的KCl、MgCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl的沉淀的质量之比为3:2:1时,三种溶液的体积比为。
(4)标准状况下VL氯化氢气体溶解在1L水中,所得溶液的密度为ρgmL,溶液中溶质的质量分数为ω,物质的量浓度为cmolL-1 , 则ω=(任写一种表达式)。
【答案】
(1)相等;2∶3;1∶1;2∶3
(2)2NA;44.8
(3)9∶3∶1
(4)![]()
【解析】(1)0.2molO3和0.3molO2的质量均为9.6g,即相等,分子数之比等于它们的物质的量之比,为2:3,0.2molO3含有的氧原子的物质的量 0.6mol,0.3molO2含有的氧原子的物质的量 0.6mol,二者所含原子数之比为1:1,在相同条件下的体积之比等于它们的物质的量之比,为2:3;
(2)73gHCl物质的量= ![]() =2mol,HCl分子数目=2mol×NAmol-1=2NA , 标况下其体积=2mol×22.4L/mol=44.8L;
=2mol,HCl分子数目=2mol×NAmol-1=2NA , 标况下其体积=2mol×22.4L/mol=44.8L;
(3)均发生反应Ag++Cl-=AgCl↓,生成的AgCl沉淀的质量之比为3:2:1,则KCl、CuCl2、AlCl3含有的氯离子物质的量之比为3:2:1,则n(KCl):n(CuCl2):n(AlCl3)=3∶ ![]() ∶
∶ ![]() =9:3:1,浓度相同体积之比等于各物质的物质的量之比为9:3:1;
=9:3:1,浓度相同体积之比等于各物质的物质的量之比为9:3:1;
(4)根据c= ![]() 公式可知ω=
公式可知ω= ![]() 。
。
【考点精析】本题主要考查了气体的摩尔体积的概念和物质的量浓度的概念的相关知识点,需要掌握单位物质的量气体所占的体积叫做气体摩尔体积.用Vm表示,Vm=V÷n.常用单位L·molˉ1;以单位体积里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度;符号CB=nB(mol)/V(L) (nB是溶质B的物质的量,V是溶液体积),单位是mol·Lˉ1才能正确解答此题.

 阅读快车系列答案
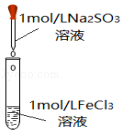
阅读快车系列答案【题目】某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1)取1molL﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示: 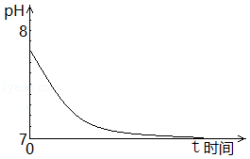
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是 .
②t时间段内,造成其pH发生上述变化,用离子方程式解释是 .
(2)探究Na2SO3溶液与FeCl3溶液实际反应的情况: 实验ⅰ
装置 | 操作 | 现象 |
| 向2mL1molL﹣1FeCl3溶液中,逐滴滴加1moL﹣1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
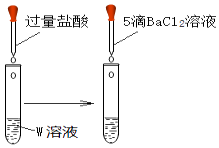
实验ⅱ
装置 | 操作 | 现象 |
| 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
①实验ⅱ证明,溶液中含有离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ , W溶液中c(Fe2+)一定很大,反应的离子方程式是 .
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色. ①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是 .
②实验过程和结果显示,O2、Fe3+、SO42﹣的氧化性强弱顺序是 .
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是 .
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是 .
【题目】元素周期表是学习和研究化学的重要工具。短周期元素甲~戊在元素周期表中的相对位置如表所示,下列判断正确的是
甲 | 乙 | 丙 |
丁 | 戊 |
A. 原子半径:丙>甲B. 原子核外电子层数:戊<丁
C. 原子核外最外层电子数:丙>戊>丁D. 元素的最高价氧化物的水化物的酸性:戊<丁