题目内容
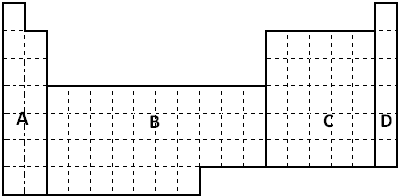
(1)在下面元素周期表中全部是金属元素的区域为___________________。(填符号)
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
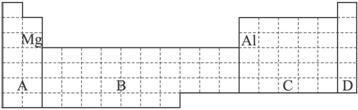
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
甲____________________。乙____________________。
②甲、乙两元素相比较,金属性较强的是_____________________(填名称);
③请设计一个简单实验方案验证甲、乙两元素的金属性的相对强弱。(要求:写出实验步骤、实验现象、实验结论)
解析:(1)副族元素均为金属元素。(2)由题意可知甲元素为短周期元素,在冷的浓硫酸中会钝化,为铝元素;乙元素原子核外M电子层与K电子层上的电子数相等,所以为镁元素。镁的金属性比铝强,可以通过与酸或水反应的剧烈程度来验证。
答案:(1)B
(2)①甲:第三周期ⅢA族;乙:第三周期ⅡA族
②镁
③实验步骤:分别取一小块镁片、铝片打磨掉氧化膜,然后投入盛有少量水的试管中,并分别滴入2滴酚酞试液;
实验现象:镁与水反应明显,有气泡产生,溶液变红色,铝与水没有明显变化。
实验结论:金属性 Mg>Al
方程式:Mg +2HCl![]() MgCl2+ H2↑
MgCl2+ H2↑
2Al +6HCl![]() 2AlCl3+3H2↑
2AlCl3+3H2↑

(1)在下面元素周期表中全部是金属元素的区域为 。
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等
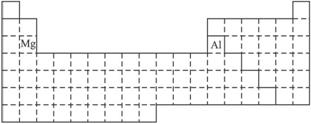
① 用元素符号将甲、乙两元素填写在下面元素周期表中对应的位置。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② 甲、乙两元素相比较,金属性较强的是 (填化学式),可以验证该结论的实验是
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性