题目内容
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )
| A.0.15 mol CuO | B.0.1 mol CuCO3 |
| C.0.075mol Cu(OH)2 | D.0.05 mol Cu2(OH)2CO3 |
D
解析试题分析:根据题给图像分析,电解过程第一阶段发生的反应为2CuSO4+2H2O 2Cu+O2↑+2H2SO4,转移的电子为0.2mol,电解生成的铜为0.1mol,氧气为0.05mol;第二阶段发生的反应为
2Cu+O2↑+2H2SO4,转移的电子为0.2mol,电解生成的铜为0.1mol,氧气为0.05mol;第二阶段发生的反应为
2H2O 2H2↑+O2↑,转移的电子为0.1mol,电解消耗的水为0.05mol。欲使溶液恢复到起始状态,根据原子守恒及题给选项知,可向溶液中加入0.05 mol Cu2(OH)2CO3,(产生的二氧化碳从溶液中逸出)选D。
2H2↑+O2↑,转移的电子为0.1mol,电解消耗的水为0.05mol。欲使溶液恢复到起始状态,根据原子守恒及题给选项知,可向溶液中加入0.05 mol Cu2(OH)2CO3,(产生的二氧化碳从溶液中逸出)选D。
考点:考查电解原理。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。下列说法中正确的是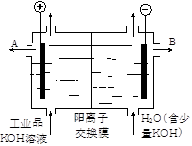
| A.该电解槽的阳极反应式是4OH--2e-→2H2O+ O2↑ |
| B.通电开始后,阴极附近溶液pH会减小 |
| C.除去杂质后氢氧化钾溶液从液体出口A导出 |
| D.用氯化钾制备氢氧化钾也可采用这种离子交换膜电解法 |
下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中会因化学腐蚀渐渐变暗 |
| B.地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀 |
| C.海轮外壳连接锌块是采用牺牲阴极的阳极保护法保护外壳不受腐蚀 |
| D.当镀锡铁制品的镀层破损时,锡镀层仍能对铁制品起保护作用 |
用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是
| A.CuCl2 (CuO) | B.NaOH (NaOH) |
| C.CuSO4 (CuCO3) | D.NaCl (NaOH) |
通过NOx传感器可监测NOx的含量,其工作原理示意图如下: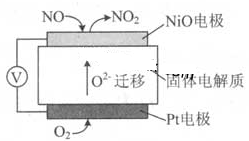
下列说法正确的是 ( )
| A.NiO 电极是该电池的正极 |
| B.Pt电极附近的pH 增大 |
| C.NiO 电极的电极反应式:NO—2e—+O2—=NO2 |
| D.固体电解质中O2-向正极移动 |
下列说法正确的是( )。
| A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池 |
| B.燃料电池是一种高效但是会污染环境的新型电池 |
| C.化学电池的反应基础是氧化还原反应 |
| D.铅蓄电池放电的时候正极材料是Pb,负极材料是PbO2 |
控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是( )
Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是( )
| A.在外电路中,电子从石墨电极流向银电极 |
| B.盐桥中的K+移向乙烧杯 |
| C.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
| D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )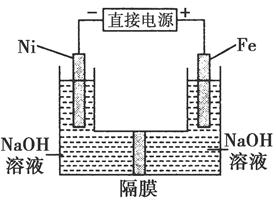
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+8H+ |
| B.镍电极上的电极反应为2H++2e-=H2↑ |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变 |
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
| A.水既是氧化剂又是溶剂 |
| B.放电时正极上有氢气生成 |
| C.放电时OH-向正极移动 |
| D.总反应为:2Li+2H2O=2LiOH+H2↑ |