题目内容
【题目】已知反应mX(g)+nY(g)qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的 ![]() 倍
倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
【答案】B
【解析】解:A、通入稀有气体总压增大,分压不变,平衡不动,故A错误; B、速率之比等于化学方程式的系数之比,v(X)正:v(Y)正=m:n,平衡时,X的正反应速率是Y的逆反应速率的 ![]() 倍,故B正确;
倍,故B正确;
C、反应是放热反应,降温平衡正向进行,反应前后气体体积减小,过程中气体质量不变,混合气体的相对分子质量增大,故C错误;
D、增加X的量会提高Y的转化率,Y的转化率降低,本身转化率减小;故D错误;
故选B.
A、通入稀有气体总压增大,分压不变,平衡不动;
B、速率之比等于化学方程式的系数之比,平衡状态整你分压速率相同;
C、反应是放热反应,降温平衡正向进行,反应前后气体体积减小,过程中气体质量不变,相对分子质量增大;
D、增加X的量会提高Y的转化率,本身转化率减小;

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)用标准溶液润洗滴定管2﹣3次
(B)取标准NaOH溶液注入碱式滴定管至0刻度以上2﹣3cm
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)调节液面至0或0刻度以下,记下读数
(E)移取10.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2﹣3滴酚酞
(F)在锥形瓶下垫一张白纸,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)排去碱式滴定管中气泡的方法应采用如图的操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.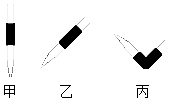
(2)E操作中在锥形瓶下垫一张白纸的作用是
(3)实验中,用左手控制(填仪器及名称),眼睛应注视 , 直至滴定终点.
(4)几次滴定消耗NaOH溶液的体积如表:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该盐酸溶液的准确浓度为 . (保留小数点后4位)
(5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是: (错选全扣)
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E.碱式滴定管滴定前无气泡,滴定后尖嘴部分有气泡.