题目内容
【题目】NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
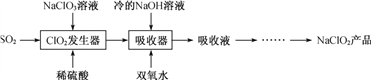
(1) ClO2发生器中发生反应的离子方程式为_________________。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I-![]() 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I-![]() 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I-![]() Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2![]() Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________。
②请计算溶液Y中ClO2-的物质的量浓度_____________(写出计算过程)。
【答案】 2SO2+ClO3-=C1O2+2SO42- 防止过氧化氢分解、提高ClO2的吸收率 蓝色褪去 0.09 mol·L-1
【解析】(1)由流程图可知C1O2发生器中目的是产生C1O2,二氧化硫具有还原性,将ClO3-还原为C1O2,自身被氧化为SO42-,反应离子方程式为2SO2+ClO3-=C1O2+2SO42-;(2)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过5℃,其目的是防止过氧化氢分解、提高ClO2的吸收率;(3) ①原溶液中生成了碘单质,加入淀粉后溶液变成蓝色,当反应结束时碘单质消失,溶液变成无色,所以滴定终点的现象为:溶液的蓝色恰好褪去,且半分钟内不恢复;②根据反应:2ClO2+2I-![]() 2ClO2-+I2、ClO2-+4H++4I-
2ClO2-+I2、ClO2-+4H++4I-![]() Cl-+2I2+2H2O、2Na2S2O3+I2
Cl-+2I2+2H2O、2Na2S2O3+I2![]() Na2S4O6+2NaI,设25.00 mLY中含有xmol C1O2、ymol ClO2-,则
Na2S4O6+2NaI,设25.00 mLY中含有xmol C1O2、ymol ClO2-,则
步骤1、2ClO2----I2-----2Na2S2O3
2 2
x ![]()
步骤2、ClO2-----2I2-----4Na2S2O3
1 4
y ![]()
x= ![]()
x+y= ![]()
y= ![]() ,c(ClO2-)=
,c(ClO2-)=![]() =0.09mol/L。
=0.09mol/L。

 名校课堂系列答案
名校课堂系列答案【题目】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解。PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请答下面问题:
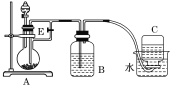
(1)选下图所示发生装置,可分别制备氯气

你选用的装置是___________,反应的离子方程式为____________
(2)实验室常用下图所示装置制取PCl3。

①玻璃管之间的连接需要用到胶皮管,连接的方法是:先把_______,然后稍稍用力即可把玻璃管插入橡皮管。
②B中所盛试剂是____________________,F中碱石灰的作用是_____________________。
③实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是______________________________,C装置中的K1、 K2的设计也出于类似的目的,为了达到这—实验目的,实验时与K1、 K2有关的操作是___________________。
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5,加入红磷时发生反应的化学方程式为_________________________,然后通过__________________(填实验操作名称),即可得到较纯净的PCl3。
(4) 通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI, I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_______ 。