题目内容
一定条件下,向含HNO3的废水中加入CH3OH进行污水处理,发生反应
 下列说法正确的是
下列说法正确的是

 下列说法正确的是
下列说法正确的是| A.CH3OH被氧化,表现氧化性 |
| B.此条件下还原性强弱为:N2>CH3OH |
| C.若氧化产物比还原产物多0.2 mol,则该反应中转移3 mole- |
| D.该反应过程中断裂的化学键既有极性键又有非极性键 |
C
试题分析:该反应中氮的化合价降低,被还原,是氧化剂。A中CH3OH被氧化,应表现还化性,错误。 B.此条件下还原性强弱为:还原剂的还原性强于还原产物的还原性,正确表述为CH3OH>N2,错误。 D.该反应过程中断裂的化学键只有极性键没有非极性键,错误。

练习册系列答案
相关题目
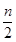 时,反应的离子方程式为:2Fe2++ Cl2 → 2Fe3++ 2Cl-
时,反应的离子方程式为:2Fe2++ Cl2 → 2Fe3++ 2Cl-
 CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强