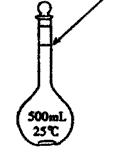
题目内容
(7分)如下图所示,烧杯中都盛有稀硫酸。?
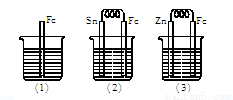
(1)中反应的离子方程式为 。(2分)?
(2)中的电极反应:Fe: ,?Sn: 。?
(3)中被腐蚀的金属是 ,其电极反应式为 。?
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 。
(共7分)(1)Fe+2H+==Fe2++H2↑(2分)
(2)Fe-2e-==Fe2+(1分) , 2H++2e-==H2↑(1分)
(3)Zn(1分) , Zn-2e-==Zn2+(1分) , (2)>(1)>(3)(1分)
【解析】(1)装置(1)铁中间和稀硫酸反应置换反应,方程式为Fe+2H+==Fe2++H2↑。
(2)装置(2)中铁比锡活泼,所以铁是负极,锡是正极,电极反应式分别是Fe-2e-==Fe2+、2H++2e-==H2↑。
(3)装置(3)中锌比铁活泼,所以锌是负极,铁是正极,因此倍腐蚀的是锌,方程式为Zn-2e-==Zn2+。根据以上分析可知,(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(2)>(1)>(3)。

 名校课堂系列答案
名校课堂系列答案![]() 某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
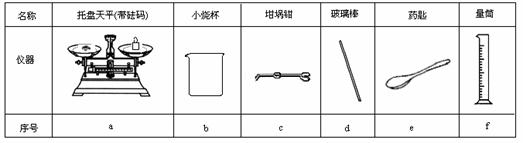
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
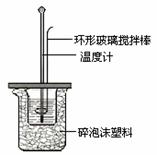
Ⅱ.测定中和热的实验装置如下图所示。
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g?℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度