ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΡ≥Ά§―ß‘Ύ”ΟœΓΝρΥα”κ–Ω÷Τ»Γ«βΤχΒΡ Β―ι÷–Θ§ΖΔœ÷Ζ¥”ΠΧθΦΰ≤ΜΆ§Θ§Ζ¥”ΠΥΌ¬ ≤ΜΆ§ΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©‘Ύ”ΟœΓΝρΥα”κ–Ω÷Τ«βΒΡ Β―ι÷–Θ§Φ”»κ…ΌΝΩœ¬Ν–Έο÷ Ω…Φ”Ωλ«βΤχ…ζ≥…ΥΌ¬ ΒΡ «_____Θ®Χν–ρΚ≈Θ©
A.Na2SO4 »ή“Κ B.MgSO4 »ή“Κ C.SO3 D.CuSO4 »ή“Κ
Θ®2Θ©ΈΣΝΥΫχ“Μ≤Ϋ―–ΨΩΝρΥαΆ≠ΒΡΝΩΕ‘«βΤχ…ζ≥…ΥΌ¬ ΒΡ”ΑœλΘ§ΗΟΆ§―ß…ηΦΤΝΥ»γœ¬“ΜœΒΝ–ΒΡ Β―ιΘΚΫΪ±μ÷–ΥυΗχΒΡΜλΚœ»ή“ΚΖ÷±πΦ”»κΒΫ6Ηω Δ”–ΙΐΝΩZnΝΘΒΡ»ίΤς÷–Θ§ ’Φ·≤ζ…ζΒΡΤχΧεΘ§Φ«¬ΦΜώΒΟœύΆ§ΧεΜΐΒΡΤχΧεΥυ–η ±ΦδΓΘ
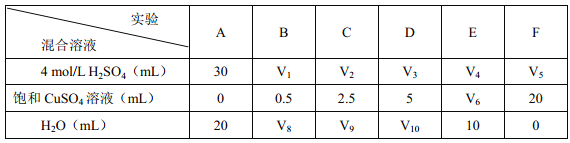
«κΆξ≥…¥Υ Β―ι…ηΦΤΘ§Τδ÷–ΘΚV1ΘΫ____ mLΘ§ V6ΘΫ______ mLΓΘ
ΗΟΆ§―ßΉνΚσΒΟ≥ωΒΡΫα¬έΈΣΘΚΒ±Φ”»κ…ΌΝΩCuSO4»ή“Κ ±Θ§…ζ≥…«βΤχΒΡΥΌ¬ Μα¥σ¥σΧαΗΏΘ§ΒΪΒ±Φ”»κΒΡCuSO4»ή“Κ≥§Ιΐ“ΜΕ®ΝΩ ±Θ§…ζ≥…«βΤχΒΡΥΌ¬ Ζ¥ΕχΜαœ¬ΫΒΓΘ«κΖ÷ΈωΥΌ¬ œ¬ΫΒΒΡ÷ς“Σ‘≠“ρ__________ ΓΘ
Θ®3Θ©ΗΟΆ§―ßΈΣΧΫΨΩΤδΥϋ“ρΥΊΕ‘–Ω”κœΓΝρΥαΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΘ§”÷ΉωΝΥ“‘œ¬ Β―ιΘ§Φ«¬Φ ΐΨί»γœ¬Θ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
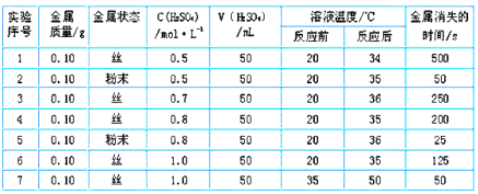
ΔΌ”… Β―ιΩ…ΆΤ÷ΣΘ§Ζ¥”ΠΈοΒΡΉήΡήΝΩ_______≤ζΈοΒΡΉήΡήΝΩΘ®ΧνΓΑΘΦΓ±ΓΔ ΓΑΘΨΓ± ΜρΓΑΘΫΓ±Θ©ΓΘ
ΔΎ Β―ι2ΚΆ5±μΟςΘ§______Ε‘Ζ¥”ΠΥΌ¬ ”–”ΑœλΓΘ
Δέ Β―ι4ΚΆ5±μΟςΘ§______Ε‘Ζ¥”ΠΥΌ¬ ”–”ΑœλΘ§Ρή±μΟςΆ§“ΜΙφ¬…ΒΡ Β―ιΜΙ”– _________ Θ®Χν Β―ι–ρΚ≈Θ©ΓΘ
Δή±Ψ Β―ι÷–”ΑœλΖ¥”ΠΥΌ¬ ΒΡΤδΥϊ“ρΥΊΜΙ”–________ΓΘ
ΓΨ¥πΑΗΓΩ C D 30 10 Β±Φ”»κ“ΜΕ®ΝΩΒΡΝρΥαΆ≠ΚσΘ§…ζ≥…ΒΡΒΞ÷ Ά≠Μα≥ΝΜΐ‘Ύ–ΩΒΡ±μΟφΘ§ΫΒΒΆΝΥ–Ω”κ»ή“ΚΒΡΫ”¥ΞΟφΜΐ ΘΨ ≈®Ε» ΙΧΧε±μΟφΜΐ 1ΚΆ2 Έ¬Ε»
ΓΨΫβΈωΓΩΘ®1Θ©‘Ύ”ΟœΓΝρΥα”κ–Ω÷Τ«βΤχΒΡ Β―ι÷–Θ§Φ”»κNa2SO4 »ή“ΚΘ§Φθ–ΓΝΥΝρΥαΒΡ≈®Ε»Θ§ ΙΥΌ¬ Φθ–ΓΘ§Ι A¥μΈσΘΜBΓΔΦ”»κMgSO4 »ή“ΚΘ§Φθ–ΓΝΥΝρΥαΒΡ≈®Ε»Θ§ ΙΥΌ¬ Φθ–ΓΘ§Ι B¥μΈσΘΜCΓΔΆ®»κSO3 œύΒ±”ΎΦ”»κΝΥΝρΥαΘ§‘ω¥σΝΥΝρΥαΒΡ≈®Ε»Θ§Φ”ΩλΝΥΜ·―ßΖ¥”ΠΥΌ¬ ΘΜDΓΔΦ”»κCuSO4 »ή“ΚΘ§–ΩΈΣΜνΤΟΫπ τΘ§ΖΔ…ζZn+CuSO4=ZnSO4+CuΘ§÷ΟΜΜ≥ωΆ≠Θ§”κ–Ω–Έ≥…‘≠Βγ≥ΊΖ¥”ΠΘ§Μ·―ßΖ¥”ΠΥΌ¬ Φ”ΩλΘΜΙ ―ΓCDΘΜ
Θ®2Θ©―–ΨΩΝρΥαΆ≠ΒΡΝΩΕ‘«βΤχ…ζ≥…ΥΌ¬ ΒΡ”Αœλ“Σ«σΝρΥαΒΡΝΩ≤Μ±δΘ§Υυ“‘V1=30Θ§Ζ÷ΈωΩ…“‘Ω¥≥ωΈΣΝΥœϊ≥ΐΝρΥαΒΡΈο÷ ΒΡΝΩ≈®Ε»≤ΜΆ§“ΐΤπΒΡΈσ≤νΘ§Υυ“‘Φ”»κΒΡΝρΥαΆ≠ΚΆΥ°ΒΡΧεΜΐΚΆ“Σ«σ“Μ―υΈΣ20mLΘ§Υυ“‘V6ΘΫ 10 Θ§Φ”»κ…ΌΝΩCuSO4»ή“Κ ±Θ§…ζ≥…«βΤχΒΡΥΌ¬ Μα¥σ¥σΧαΗΏΘ§ΒΪΒ±Φ”»κΒΡCuSO4»ή“Κ≥§Ιΐ“ΜΕ®ΝΩ ±Θ§…ζ≥…«βΤχΒΡΥΌ¬ Ζ¥ΕχΜαœ¬ΫΒΓΘ«κΖ÷Έω«βΤχ…ζ≥…ΥΌ¬ œ¬ΫΒΒΡ÷ς“Σ‘≠“ρ «Β±Φ”»κ“ΜΕ®ΝΩΒΡΝρΥαΆ≠ΚσΘ§…ζ≥…ΒΡΒΞ÷ Ά≠Μα≥ΝΜΐ‘Ύ–ΩΒΡ±μΟφΘ§ΫΒΒΆΝΥ–Ω”κ»ή“ΚΒΡΫ”¥ΞΟφΜΐΘΜ
Θ®3Θ©ΔΌ ¥”±μ÷–Ω¥≥ωΘ§Ζ¥”ΠΚσΒΡΈ¬Ε»ΗΏ”ΎΖ¥”Π«ΑΒΡΈ¬Ε»Θ§ΥΒΟς’β «“ΜΗωΖ≈»»Ζ¥”ΠΘ§Φ¥Ζ¥”ΠΈοΒΡΉήΡήΝΩ¥σ”Ύ≤ζΈοΒΡΉήΡήΝΩΘΜ
ΔΎ Β―ι2ΚΆ5±μΟς÷Μ“ΣΝρΥαΒΡΈο÷ ΒΡΝΩ≈®Ε»≤ΜΆ§Θ§ «ΈΣΝΥΧΫΨΩ≈®Ε»Ε‘Ζ¥”ΠΥΌ¬ ΒΡ”ΑœλΘΜ
Δέ Β―ι4ΚΆ5ΓΔ1ΚΆ2Θ§ΕΦ «ΈΣΝΥΧΫΨΩΙΧΧε±μΟφΜΐΕ‘Ζ¥”ΠΥΌ¬ ΒΡ”ΑœλΘ§ΖέΡ©Ζ¥”ΠΒΡ ±ΦδΕΧΘ§ΥΒΟςΙΧΧε±μΟφΜΐ‘Ϋ¥σΘ§Ζ¥”ΠΥΌ¬ ‘ΫΩλΘΜ
Δή”…”Ύ’β «“ΜΗωΖ≈»»Ζ¥”ΠΘ§Υυ“‘Έ¬Ε»“≤ «”Αœλ±Ψ Β―ιΒΡΖ¥”ΠΥΌ¬ ΒΡ“ρΥΊ÷°“ΜΓΘ

 Ωλά÷–Γ≤© ΩΙ°ΙΧ”κΧαΗΏœΒΝ–¥πΑΗ
Ωλά÷–Γ≤© ΩΙ°ΙΧ”κΧαΗΏœΒΝ–¥πΑΗ