题目内容
【题目】为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
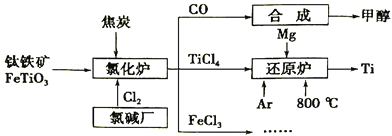
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:__________。己知氯化炉中反应的氧气和焦炭的理论用料物质的量比为7:6,则氯化炉中发生的化学方程式为:___________。其中还原剂的化学式是__________。
(2)氩气(Ar)通入还原炉中并不参与反应,通入Ar气的作用是:__________。
已知TiC14 和Mg反应时放热,则反应物的总能量______(填“大于”或“小于”或者“等于”) 生成物的总能量。
(3)以甲醇(CH3OH)、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式为_________。标准状况下,通入11.2LO2并完全反应后,有______mol电子转移。工作一段时间后,测得溶液的pH____(填“减小”、“增大”或“不变”)。
【答案】 增大反应物间接接触面积,提高反应速率 6C+2Cl2+2FeTiO3=6CO+2TiCl4+2FeCl3 C和FeTiO3 Mg和Ti都有强还原性,在Ar气氛围中可防止被氧化 大于 CH3OH-6e-+8OH-=CO32-+6H2O 2 减小
【解析】(1)粉碎反应物,可以增大其表面积,从而增大反应物之间的接触面积,提高反应速率;已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7:6,则发生的反应为6C+2Cl2+2FeTiO3![]() 6CO+2TiCl4+2FeCl3,根据化合价变化可知,C和FeTiO3为还原剂;(2)氩气性质不活泼可以防止Mg和Ti等具有强还原性的物质被氧化,即作用是:Mg和Ti都有强还原性,在Ar气氛围中可防止被氧化;已知TiC14 和Mg反应时放热,则反应物的总能量大于生成物的总能量。(3)甲醇失去电子,则甲醇在负极通入,该电池中负极上的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。标准状况下,通入11.2LO2即0.5mol氧气,并完全反应后,有0.5mol×4=2mol电子转移。由于反应中消耗强碱,则工作一段时间后,测得溶液的pH减小。
6CO+2TiCl4+2FeCl3,根据化合价变化可知,C和FeTiO3为还原剂;(2)氩气性质不活泼可以防止Mg和Ti等具有强还原性的物质被氧化,即作用是:Mg和Ti都有强还原性,在Ar气氛围中可防止被氧化;已知TiC14 和Mg反应时放热,则反应物的总能量大于生成物的总能量。(3)甲醇失去电子,则甲醇在负极通入,该电池中负极上的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。标准状况下,通入11.2LO2即0.5mol氧气,并完全反应后,有0.5mol×4=2mol电子转移。由于反应中消耗强碱,则工作一段时间后,测得溶液的pH减小。