题目内容
大气中的部分碘源于O3对海水中Iˉ的氧化。将O3持续通入NaI酸性溶液溶液中进行模拟研究。
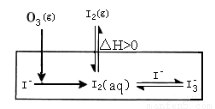
(1)O3将Iˉ氧化成I2的过程可发生如下反应:
①Iˉ(aq)+ O3(g)= IOˉ(aq) + O2(g) △H1
②IOˉ(aq)+H+(aq)  HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + Iˉ(aq) + H+(aq)  I2(aq) + H2O(l)? △H3
I2(aq) + H2O(l)? △H3
④O3(g)+2Iˉ(aq)+2H+(aq)= I2(aq) + O2(g)+ H2O(l)? △H4
则△H3与△H1、△H2、△H4之间的关系是:△H3? = ????? 。
(2)在溶液中存在化学平衡: I2(aq) + Iˉ(aq)  I3ˉ(aq)其平衡常数表达式为????? 。在反应的整个过程中I3ˉ物质的量浓度变化情况是????? 。
I3ˉ(aq)其平衡常数表达式为????? 。在反应的整个过程中I3ˉ物质的量浓度变化情况是????? 。
(3)为探究温度 对I2(aq) + Iˉ(aq)  I3ˉ(aq)? △H5? 反应的影响。在某温度T1下,将一定量的0.2 mol·L-1NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与 Iˉ反应),在t时刻,测得容器中I2(g)的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得I2(g)浓度,得到趋势图(见图一)。则:
I3ˉ(aq)? △H5? 反应的影响。在某温度T1下,将一定量的0.2 mol·L-1NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与 Iˉ反应),在t时刻,测得容器中I2(g)的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得I2(g)浓度,得到趋势图(见图一)。则:
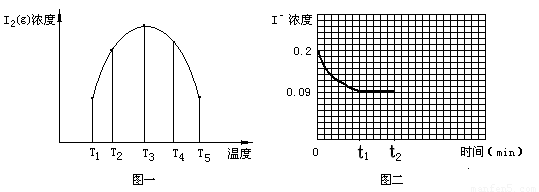
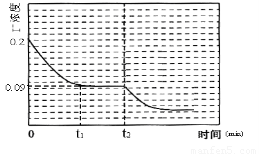
①若在T3时,容器中无O3, T4~T5温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,则△H5????? 0(填>、=或<);该条件下在温度为T4时,溶液中Iˉ浓度随时间变化的趋势曲线如图二所示。在t2时,将该反应体系温度上升到T5,并维持该温度。请在图2中画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线。
??? ②若在T3时,容器中还有O3,则T1~T2温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,其可能的原因是????? 。(任写一点)
(4)利用反应④和图2的信息,计算0-t1时间段内用I2(aq)表示的化学反应速率????? 。
(1)△H4-△H2-△H1 ;????? (2)  ?? ; 先增加后减小;
?? ; 先增加后减小;
(3)①>? ;
②O3继续氧化I-使溶液中I2浓度增加,使I2(aq)  I2(g)平衡向正方向移动,气体I2浓度增加;溶液温度升高,使I2(aq)
I2(g)平衡向正方向移动,气体I2浓度增加;溶液温度升高,使I2(aq)  I2(g) △H>0,平衡向正方向移动,气体I2浓度增加;(两条理由任写一点给2分)
I2(g) △H>0,平衡向正方向移动,气体I2浓度增加;(两条理由任写一点给2分)
(4)0.11/2t1 mol·L-1·min-1(2分)
【解析】
试题分析:(1) 观察已知的4个热化学方程式中的反应物和生成物,可以知道,由④式减②式减①式,即可得到③式,所以,△H3= △H4-△H2-△H1。
(2)依据平衡常数的定义可得反应I2(aq) + Iˉ(aq)  I3ˉ(aq)的平衡常数表达式为:
I3ˉ(aq)的平衡常数表达式为: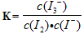 。已知O3将Iˉ氧化成I2的过程中可发生4个反应,所以在反应的整个过程中I3ˉ物质的量浓度变化情况是:开始时随着O3的通入,O3可以将I-氧化成I2,I2与I-结合形成I3-,从而使I3ˉ物质的量浓度增大;由于O3具有极强氧化性,通入的O3还可以将I-氧化为IO-和氧气,随着O3的持续通入,O3将一部分I-氧化为IO-和氧气,使I-消耗量增大,同时I2 生成量减少,从而使I3-的浓度变小。
。已知O3将Iˉ氧化成I2的过程中可发生4个反应,所以在反应的整个过程中I3ˉ物质的量浓度变化情况是:开始时随着O3的通入,O3可以将I-氧化成I2,I2与I-结合形成I3-,从而使I3ˉ物质的量浓度增大;由于O3具有极强氧化性,通入的O3还可以将I-氧化为IO-和氧气,随着O3的持续通入,O3将一部分I-氧化为IO-和氧气,使I-消耗量增大,同时I2 生成量减少,从而使I3-的浓度变小。
(3)①在T3时,容器中已无O3,所以从图示可以知道,此时,溶液中只存在两个平衡:I2(ag) I2(g) ,和 I2(aq) + Iˉ(aq)
I2(g) ,和 I2(aq) + Iˉ(aq)  I3ˉ(aq) ,根据I2(ag)
I3ˉ(aq) ,根据I2(ag) I2(g) △H>0,升高温度,I2(ag)倾向于生成I2(g),所以在不考虑其它因素时,I2(g)浓度会增加,但是从图一T4→T5 所示的I2(g)浓度变化曲线看,实际上升高温度I2(g)浓度减少,那么只能判断是温度升高致使平衡I2(aq) + Iˉ(aq)
I2(g) △H>0,升高温度,I2(ag)倾向于生成I2(g),所以在不考虑其它因素时,I2(g)浓度会增加,但是从图一T4→T5 所示的I2(g)浓度变化曲线看,实际上升高温度I2(g)浓度减少,那么只能判断是温度升高致使平衡I2(aq) + Iˉ(aq)  I3ˉ(aq) 正向移动,移动结果使I2(aq)浓度减小,从而导致I2(ag)
I3ˉ(aq) 正向移动,移动结果使I2(aq)浓度减小,从而导致I2(ag) I2(g)平衡逆向移动,使I2(g)浓度减小,由此可以判断△H5>0,I2(aq) + Iˉ(aq)
I2(g)平衡逆向移动,使I2(g)浓度减小,由此可以判断△H5>0,I2(aq) + Iˉ(aq)  I3ˉ(aq)是吸热反应。
I3ˉ(aq)是吸热反应。
要画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线,必须首先确定曲线的起点、拐
点和终点,已知图二所示的曲线是温度在T4时,溶液中Iˉ浓度随时间变化的趋势曲线,根由曲线分析可知反应己达到平衡,在t2时,反应体系温度上升到T5,并维持该温度,是改变的反应条件(升高温度),此时平衡必然会发生移动,所以T5温度下曲线的起点就是T4温度下曲线的终点,坐标位置应为(0.09,t2)。由于升高温度加快反应速率,缩短达到平衡的时间,所以在T5温度下,达到平衡所用的时间要比T4温度下少,所以拐点出现所需时间比T4温度下少。由于该反应是吸热反应,升高温度能使平衡I2(aq) + Iˉ(aq)  I3ˉ(aq)正向移动,从而使Iˉ浓度减小。结合图二中的数据可知,T4温度下Iˉ转化浓度为0.11mol/L,转化率为
I3ˉ(aq)正向移动,从而使Iˉ浓度减小。结合图二中的数据可知,T4温度下Iˉ转化浓度为0.11mol/L,转化率为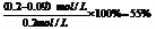 所以T5温度下Iˉ的转化率为一定大于55%,Iˉ的平衡浓度要小于0.09mol/L-(0.09mol/L×55%)≈0.04mol/L。所以拐点(平衡点)的位置坐标应在Iˉ浓度小于0.04mol/L 处,终点与拐点(平衡点)在一条直线上。由此就可画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线(见答案)。
所以T5温度下Iˉ的转化率为一定大于55%,Iˉ的平衡浓度要小于0.09mol/L-(0.09mol/L×55%)≈0.04mol/L。所以拐点(平衡点)的位置坐标应在Iˉ浓度小于0.04mol/L 处,终点与拐点(平衡点)在一条直线上。由此就可画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线(见答案)。
? ② 在T3时,容器中还有O3,则T1~T2温度区间容器内I2(g)浓度呈现如图一所示的变化趋势,可能是:a.由于容器中还有O3,O3继续氧化I-使溶液中I2浓度增加,从而使I2(aq)  I2(g)平衡向正方向移动,气体I2浓度增加;b. 体系的温度升高,使I2(aq)
I2(g)平衡向正方向移动,气体I2浓度增加;b. 体系的温度升高,使I2(aq)  I2(g) △H>0,平衡向正方向移动,从而气体I2浓度增加。
I2(g) △H>0,平衡向正方向移动,从而气体I2浓度增加。
(4) 根据图二所示Iˉ浓度的数据可计算出用Iˉ(aq)表示的化学反应速率:
V(I-) = 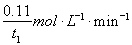 ,再根据(1)中反应④的化学方程式中Iˉ(aq)与I2(aq)的化学计量数之比2 : 1,得出用I2(aq)表示的化学反应速率:V (I2) =
,再根据(1)中反应④的化学方程式中Iˉ(aq)与I2(aq)的化学计量数之比2 : 1,得出用I2(aq)表示的化学反应速率:V (I2) =  。
。
考点:化学反应与能量、化学反应速率、化学平衡

大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)=IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq)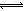 HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+ I-(aq)+ H+(aq)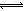 I2(aq)+H2O(l)
△H3
I2(aq)+H2O(l)
△H3
总反应的化学方程式为______,其反应△H=______。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)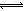 I3-(aq),其平衡常数表达式为_______。
I3-(aq),其平衡常数表达式为_______。
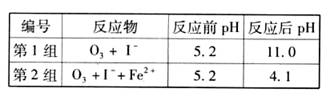
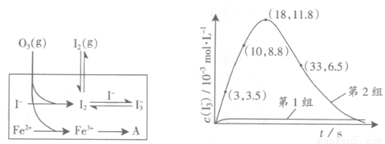
(3)为探究Fe2+对氧化I-反应的影响(反应体系如图),某研究小组测定两组实验中I3-浓度和体系pH,结果见图和下表。
|
编号 |
反应物 |
反应前pH |
反应后pH |
|
第1组 |
O3+ I- |
5.2 |
11.0 |
|
第2组 |
O3+ I-+ Fe2+ |
5.2 |
4.1 |
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为 。由Fe3+生成A的过程能显著提高I-的转化率,原因是_______。
③第2组实验进行18s后,I3-下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3~18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HOI(aq)△H2
③HOI(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
总反应的化学方程式为 ,其反应△H=
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)?I3-(aq),其平衡常数表达式为 .
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表.

| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2- | 5.2 | 4.1 |
②图1中的A为 ,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是 .
③第2组实验进行18s后,I3-浓度下降.导致下降的直接原因有(双选) .
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字).
 I2+O2+H2O
I2+O2+H2O

 I2+O2+H2O可知消耗酸,所以pH升高
I2+O2+H2O可知消耗酸,所以pH升高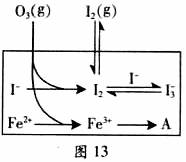 (1)O3将I-氧化成I2的过程由3步反应组成:
(1)O3将I-氧化成I2的过程由3步反应组成: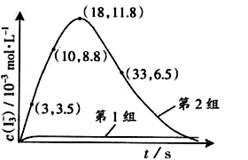 (3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
(3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。