题目内容
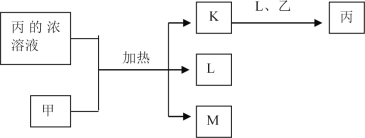
【题目】如图是用于制备乙酸乙酯的常见简易装置。请根据该装置回答下列问题:

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是先向试管中加入一定量的________,然后边振荡边缓缓加入________,冷却后再加入一定量的冰醋酸,轻轻振荡使之混合均匀。
(2)制备乙酸乙酯的化学反应方程式为_______。生成的乙酸乙酯,其密度比水_____(填“大”或“小”)。
(3)浓硫酸的作用是____________。
(4)试管B内装入饱和碳酸钠溶液,写出除去乙酸时发生反应的化学方程式_________。
(5)与书中采用的实验装置的不同之处是本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了溶液中。在此处球形干燥管的作用有________。
【答案】乙醇 浓硫酸 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 小 催化剂、吸水剂 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O 防倒吸
CH3COOCH2CH3+H2O 小 催化剂、吸水剂 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O 防倒吸
【解析】
在浓硫酸环境下,乙醇和乙酸发生取代反应生成乙酸乙酯,但乙醇和乙酸具有挥发性,极易与水反应,故在最后安装防倒吸装置,试管中加入饱和碳酸钠。
(1)浓硫酸绝对不能第一个加入,在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是先向试管中加入一定量的乙醇,然后边振荡边缓缓加入浓硫酸,冷却后再加入一定量的冰醋酸,轻轻振荡使之混合均匀。
(2)制备乙酸乙酯的化学反应方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。生成的乙酸乙酯,其密度比水小。
CH3COOCH2CH3+H2O。生成的乙酸乙酯,其密度比水小。
(3)酯化反应是可逆反应,浓硫酸的作用是催化剂、吸水剂。
(4)试管B内装入饱和碳酸钠溶液,除去乙酸时发生反应的化学方程式为2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O。
(5)与书中采用的实验装置的不同之处是本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了溶液中。球形干燥管内容量大,在此处的作用为防倒吸。

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】工业上常利用CO2为初始反应物,合成一系列重要的化工原料。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol 请回答下列问题:
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol 请回答下列问题:
①根据8电子稳定构型,写出 CO(NH2)2的结构式_________________。
②反应Ⅰ的△H1=______________。
③在____(填“高温”或“低温”)情况下有利于反应Ⅱ的自发进行。
④一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.NH3与CO2的转化率相等
D.容器内混合气体的密度不再变化
(2)将CO2和H2按质量比25:3充入一定体积的密闭容器中,在不同温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K(Ⅰ)_____K(Ⅱ)(填“ >”“<”或“=”)。
②欲提高CH3OH的平衡产率,可采取的措施除改变温度外,还有__________________(任写两种)。
③一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物起始投入量 | 1molCO2、3molH2 | a molCO2、bmolH2、cmolCH3OH(g) |
c mol H2O(g) (a、b、c 均不为零) | ||
若甲容器平衡后气体的压强为开始的 5/6,则该温度下,反应的平衡常数为__________,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中 c 的取值范围为_______。