题目内容
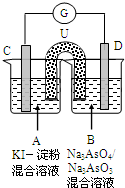
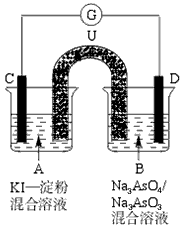
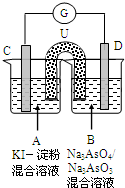 如图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极.
如图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极.(1)As(砷)位于元素周期表中第四周期VA族,则Na3AsO4溶液的pH
>7
>7
(填“>7”“<7”“=7”).(2)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移.此时A杯中的主要实验现象是
无色溶变为蓝色
无色溶变为蓝色
,D电极上的电极反应式为AsO43-+2H++e-=AsO32-+H2O
AsO43-+2H++e-=AsO32-+H2O
.(3)一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移.
此时整套实验装置的总的离子方程式为
AsO32-+I2+2H2O=2H++2I-+AsO43-
AsO32-+I2+2H2O=2H++2I-+AsO43-
.(4)再过一段时间后,G的指针逐渐归零,此时实验装置中的化学反应已经达到化学平衡状态,该反应的化学平衡常数的表达式为:K=
| [H+]2?[I-]2?[AsO43-] |
| [I2]?[AsO33-] |
| [H+]2?[I-]2?[AsO43-] |
| [I2]?[AsO33-] |
分析:(1)含有弱离子的盐能水解,“谁强显谁性”;
(2)在原电池的正极上发生得电子的还原反应,根据氧化还原反应的生成物来确定现象以及电极方程式;
(3)AsO32-和I2在水溶液中可以发生自发的氧化还原反应.
(2)在原电池的正极上发生得电子的还原反应,根据氧化还原反应的生成物来确定现象以及电极方程式;
(3)AsO32-和I2在水溶液中可以发生自发的氧化还原反应.
解答:解:(1)As(砷)位于元素周期表中第四周期VA族,联想到同族元素相似性,磷酸根离子水解时溶液显碱性,故神酸根离子水解,溶液显碱性,故PH>7,故答案为:>7;
(2)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移,“G是灵敏电流计,其指针总是偏向电源正极”所以所以说电子从C跑到D,即碘离子发生氧化反应,失去电子,生成碘单质遇到淀粉变蓝,是浓硫酸将低价的亚砷酸根离子氧化,该离子发生还原反应,实质是:AsO43-+2H++e-=AsO32-+H2O,故答案为:无色溶变为蓝色;AsO43-+2H++e-=AsO32-+H2O;
(3)再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移,说明C是正极,D是负极,A中发生碘单质失电子的反应,B中发生亚砷酸失电子的反应,总反应为:AsO32-+I2+2H2O=2H++2I-+AsO43-,故答案为:AsO32-+I2+2H2O=2H++2I-+AsO43-;
(4)根据反应AsO32-+I2+2H2O=2H++2I-+AsO43-,该反应的化学平衡常数的表达式为:K=
,故答案为::
.
(2)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移,“G是灵敏电流计,其指针总是偏向电源正极”所以所以说电子从C跑到D,即碘离子发生氧化反应,失去电子,生成碘单质遇到淀粉变蓝,是浓硫酸将低价的亚砷酸根离子氧化,该离子发生还原反应,实质是:AsO43-+2H++e-=AsO32-+H2O,故答案为:无色溶变为蓝色;AsO43-+2H++e-=AsO32-+H2O;
(3)再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移,说明C是正极,D是负极,A中发生碘单质失电子的反应,B中发生亚砷酸失电子的反应,总反应为:AsO32-+I2+2H2O=2H++2I-+AsO43-,故答案为:AsO32-+I2+2H2O=2H++2I-+AsO43-;
(4)根据反应AsO32-+I2+2H2O=2H++2I-+AsO43-,该反应的化学平衡常数的表达式为:K=
| [H+]2?[I-]2?[AsO43-] |
| [I2]?[AsO33-] |
| [H+]2?[I-]2?[AsO43-] |
| [I2]?[AsO33-] |
点评:本题考查学生原电池的工作原理知识,难度较大,出题思路新颖.

练习册系列答案
相关题目