题目内容
【题目】用如图所示装置可以进行电镀,下列说法不正确的是

A. 电镀时待镀的金属制品作阴极,镀层金属作阳极
B. 用含有镀层金属离子的溶液做电镀液
C. 将待镀铁件改为粗铜板,即可进行铜的精炼
D. 电镀废水排放前必须经过处理
【答案】C
【解析】
与电源的正极相连的是阳极,和电源的负极相连的是阴极,所以铜片是阳极,待镀铁件是阴极。电镀时电镀液要含有镀层金属离子。
A. 由分析可知,电镀时待镀的金属制品作阴极,镀层金属作阳极,A项正确;
B. 由分析可知,阴极反应会消耗Cu2+,电镀液要含有镀层金属离子Cu2+,B项正确;
C. 铜的精炼时粗铜板作阳极材料,故应该将铜片改为粗铜板,C项错误;
D. 电镀废水含有重金属离子Cu2+,会污染环境,排放前必须经过处理,D项正确;
答案选C。

 出彩同步大试卷系列答案
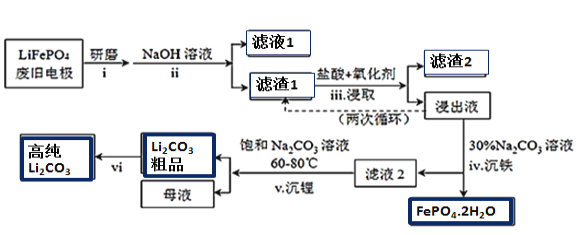
出彩同步大试卷系列答案【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程如图:
资料:碳酸锂在水中溶解度随温度变化如下:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是__________________。
(2)过程ii加入足量NaOH溶液的作用(用化学反应方程式表示)_________________。
(3)如过程iii采用NaClO3作为氧化剂,则过程中会反应会发生副反应生成黄绿色气体,
①该副反应对应的离子方程式为_______________________________________________________;
从环保角度分析,选择___________(填字母)作为该过程的氧化剂会更好。
a.H2O2 b.浓硫酸 c.浓HNO3
②过程iii得到的浸出液循环两次的目的是________________________________________________。
(4)浸出液中存在大量H2PO4﹣和HPO42-,已知:![]() ,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因______________________________________。
(5)简述过程vi的操作______________________________________________________________。