题目内容
已知汽车尾气无害化处理反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g).下列说法不正确的是( )
分析:A、化学平衡是动态平衡,平衡时正、逆速率相等,不为0;
B、使用催化剂改变反应途径,加快反应速率;
C、升高温度,增大活化分子百分数,反应加快;
D、可逆反应到达平衡时,不同物质表示的正、逆速率之比等于化学计量数之比.
B、使用催化剂改变反应途径,加快反应速率;
C、升高温度,增大活化分子百分数,反应加快;
D、可逆反应到达平衡时,不同物质表示的正、逆速率之比等于化学计量数之比.
解答:解:A、化学平衡是动态平衡,平衡时正、逆速率相等,不为0,生成与消耗相等,反应混合物各组分的量不变,故A错误;
B、使用催化剂降低活化能,改变反应途径,加快反应速率,故B正确;
C、升高温度,增大活化分子百分数,增大单位体积内的活化分子数目,反应速率加快,故C正确;
D、不同物质表示的正、逆速率之比等于化学计量数之比,反应到达平衡,故D正确.
故选A.
B、使用催化剂降低活化能,改变反应途径,加快反应速率,故B正确;
C、升高温度,增大活化分子百分数,增大单位体积内的活化分子数目,反应速率加快,故C正确;
D、不同物质表示的正、逆速率之比等于化学计量数之比,反应到达平衡,故D正确.
故选A.
点评:本题考查影响化学反应速率的因素、化学平衡状态特征与判断等,难度不大,注意基础知识的积累理解.

练习册系列答案
相关题目
已知汽车尾气无害化处理反应为:2NO(g)+2CO(g)?N2(g)+2CO2(g).下列说法不正确的是( )
| A、在上述条件下,NO能完全转化为N2 | B、使用高效催化剂可提高正反应速率 | C、反应达到平衡后,NO的反应速率保持恒定 | D、升高温度可使该反应的逆反应速率增大 |
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)═N2(g)+2CO2(g).下列说法不正确的是( )
| A、升高温度可减慢反应速率 | B、使用催化剂可加快反应速率 | C、反应达到平衡后,NO的浓度保持恒定 | D、该反应中NO为氧化剂 |


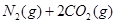 下列说法不正确的是
下列说法不正确的是