题目内容
下列叙述正确的是
A.将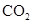 通入 通入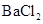 溶液中至饱和,无沉淀产生;再通入 溶液中至饱和,无沉淀产生;再通入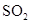 ,产生沉淀 ,产生沉淀 |
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入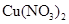 固体,铜粉仍不溶解 固体,铜粉仍不溶解 |
C.向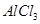 溶液中滴加氨水,产生白色沉淀;再加入过量 溶液中滴加氨水,产生白色沉淀;再加入过量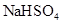 溶液,沉淀消失 溶液,沉淀消失 |
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量 固体,速率不改变 固体,速率不改变 |
C
解析试题分析:A、SO2与CO2对应的酸都比盐酸弱,所以都不与BaCl2反应,所以通入SO2与CO2都不会生成沉淀,故A错误; B.在稀硫酸中加入铜粉,铜粉不溶解;再加入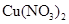 固体,铜粉会溶解,因为前者提供了氢离子,后者提供了硝酸酸离子,相当于有了硝酸,硝酸具有强氧化性能和铜发生反应,错误; C.向
固体,铜粉会溶解,因为前者提供了氢离子,后者提供了硝酸酸离子,相当于有了硝酸,硝酸具有强氧化性能和铜发生反应,错误; C.向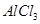 溶液中滴加氨水,产生白色沉淀是氢氧化铝,再加入过量
溶液中滴加氨水,产生白色沉淀是氢氧化铝,再加入过量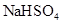 溶液,该物质能电离出氢离子,酸性较强,又溶解了氢氧化铝沉淀,正确; D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量
溶液,该物质能电离出氢离子,酸性较强,又溶解了氢氧化铝沉淀,正确; D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量 固体后,有铜置换出来,形成了锌铜原电池加了反应速率,错误;
固体后,有铜置换出来,形成了锌铜原电池加了反应速率,错误;
考点:本题考查了元素及其化合物的知识,掌握物质间的反应是解题的关键,要求学生熟记教材知识,学以致用。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列物质久置于空气中因被氧化而变质且有明显颜色改变的是( )
| A.KMnO4 | B.CuSO4 | C.FeSO4?7H2O | D.C6H5OH |
下列说法不合理的是
| A.FeCl2、Na2O2、NaHCO3均可通过化合反应生成 |
| B.在稀硫酸中加入铜粉,铜粉不溶解,若加入KNO3固体,铜粉溶解 |
| C.用渗析的方法可除去Fe(OH)3胶体中混有的Cl- |
| D.氧化铝具有高熔点,用氧化铝制作的坩埚可用来蒸发浓缩烧碱溶液 |
下列叙述不正确的是
| A.酒精和硝酸银溶液均能使蛋白质变性 |
| B.乙烯和二氧化硫均能使酸性KMnO4溶液褪色 |
| C.水晶项链、光导纤维、玻璃、瓷器等都是硅酸盐制品 |
| D.反应AgBr + KI =" AgI" + KBr能在水溶液中进行,是因为AgI比AgBr更难溶于水 |
为提高农作物产量,改善农作物品质,有一种向温室内定期施放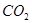 的方法是:将工业废稀
的方法是:将工业废稀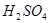 按1:4用水稀释后,盛放在塑料桶内悬挂于1.2米的高处,每天向桶内加入适量的某物质。下列物质中最适宜加入的是
按1:4用水稀释后,盛放在塑料桶内悬挂于1.2米的高处,每天向桶内加入适量的某物质。下列物质中最适宜加入的是
A.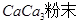 | B.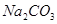 粉末 粉末 |
C.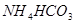 粉末 粉末 | D.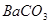 粉末 粉末 |
下列根据实验操作和现象所得出的结论正确的是:( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 洁净的铁钉在浓硝酸中浸泡片刻,蒸馏水冲洗后,再放入CuSO4溶液 | 铁钉表面无红色物质生成 | 铁钉在浓硝酸中已钝化 |
| B | 向溶液X中先滴加稀NaOH溶液,再将湿润红色石蕊试纸置于试管口附近 | 试纸不变蓝 | 原溶液X中肯定无NH4+ |
| C | 向PbO2中滴入浓盐酸 | 有黄绿色气体 | PbO2具有还原性 |
| D | 向溶液X 中先滴加氯水,再滴加KSCN溶液 | 溶液变红 | 溶液X中一定含有Fe2+ |
下列选项中,有关实验操作、现象和结论都正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量的CO2通入CaCl2溶液中 | 无白色沉淀出现 | 生成的Ca(HCO3)2可溶于水 |
| B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
| C | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3 |
| D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
下列变化能够实现的是
①弱酸与盐溶液反应生成强酸 ②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性 ④复分解反应中既没有生成水,也没有生成沉淀和气体
| A.①③ | B.②④ | C.①②④ | D.①②③④ |