题目内容
3.在反应:C+CO2═2CO中,不能使反应速率增大的是( )| A. | 增加碳的量 | B. | 升高温度 | C. | 通入CO2 | D. | 用碳粉代替焦炭 |
分析 对于反应C+CO2?2CO来说,增大浓度、越强、升高温度或增大固体的表面积可增大反应速率,以此解答该题.
解答 解:A.增加碳的量,物质的浓度不变,反应速率不变,故A选;
B.升高温度,活化分子百分数增大,反应速率增大,故B不选;
C.通入CO2,反应物浓度增大,则反应速率增大变,故C不选;
D.用碳粉代替焦炭,固体表面积增大,反应速率增大,故D不选.
故选A.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,本题注意把握反应方程式的特征,把握影响反应速率的因素和原因,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
14.下列各组离子中,可以大量共存的是( )
| A. | Ag+、NO3-、Cl- | B. | OH-、Cl-、NH4+ | C. | Ba2+、Cl-、SO42- | D. | Mg2+、Cl-、NO3- |
11. 异鼠李素的结构简式如图所示.当与等量该有机物反应时,最多消耗Br2、Na、NaOH的物质的量之比为( )
异鼠李素的结构简式如图所示.当与等量该有机物反应时,最多消耗Br2、Na、NaOH的物质的量之比为( )
 异鼠李素的结构简式如图所示.当与等量该有机物反应时,最多消耗Br2、Na、NaOH的物质的量之比为( )
异鼠李素的结构简式如图所示.当与等量该有机物反应时,最多消耗Br2、Na、NaOH的物质的量之比为( )| A. | 1:1:1 | B. | 4:4:3 | C. | 5:4:3 | D. | 3:5:1 |
18.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液.下列说法正确的是( )
| A. | 电流方向是由Zn经导线到K2FeO4 | |
| B. | 正极反应式为 2FeO42-+10H++6e-═Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |
15.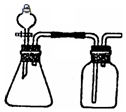 利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
①亚硫酸钠和浓硫酸
②铝和烧碱溶液
③铜和稀硝酸
④铜和浓硫酸
⑤双氧水(H2O2)和二氧化锰
⑥铜和浓硝酸.
 利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )
利用下列各组物质能制备和收集相应的气体,且可采用如图所示装置(图中尾气处理装置略)的是( )①亚硫酸钠和浓硫酸
②铝和烧碱溶液
③铜和稀硝酸
④铜和浓硫酸
⑤双氧水(H2O2)和二氧化锰
⑥铜和浓硝酸.
| A. | ①⑤⑥ | B. | ①③⑥ | C. | ①②⑤ | D. | ③⑤⑥ |
12.在一定温度下,将2molSO2和1molO2充入一固定容积的密闭容器中,在催化剂作用下发生如下放热反应:2SO2(g)+O2(g)?2SO3(g),对该反应的下列说法中正确的是( )
| A. | 若向该体系中通入过量的二氧化硫,则氧气的转化率可达到100% | |
| B. | 该反应过程中SO2和O2的总能量一定低于SO3的总能量 | |
| C. | 当达到化学平衡时,该容器中SO2和SO3共2mol | |
| D. | 当达到反应限度时,单位时间内生成nmolO2,同时消耗2n molSO3 |
11.19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( )
| A. | 提出了原子学说 | B. | 提出了元素周期律 | ||
| C. | 提出了相对论 | D. | 制定了第一张元素周期表 |