题目内容
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是 ( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
C
【解析】K1= 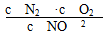 ,A错误;水分解的平衡常数为
,A错误;水分解的平衡常数为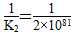 =5×10-82,B错误,NO、H2O、CO2三种化合物分解出O2的K值分别为1×1030、5×10-82、4×10-92,所以NO>H2O>CO2,C项正确,D项错误。
=5×10-82,B错误,NO、H2O、CO2三种化合物分解出O2的K值分别为1×1030、5×10-82、4×10-92,所以NO>H2O>CO2,C项正确,D项错误。

25°C时,弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
下列有关说法正确的是 ( )
A.等物质的量浓度的各溶液的pH关系为:
pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1HCN与b mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力增大
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素的性质或原子结构 |
X | 最外层电子数是次外层电子数的3倍 |
Y | 常温下单质是双原子分子,其氢化物的水溶液显碱性 |
Z | 第三周期元素的简单离子中半径最小 |
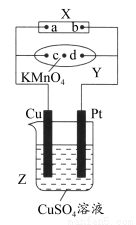
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是 ,元素Z的离子结构示意图为 。
(2)元素Y与氢元素形成一种离子YH4+,请写出检验溶液中存在该离子的实验操作、现象和结论 。
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式: 。
(4)元素X与元素Y相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.Y的氢化物可在纯X2中燃烧生成X的氢化物和Y2
b.X的单质比Y的单质更容易与H2化合
c.X与Y形成的化合物中Y元素呈正价态