题目内容
向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g)
 pC(g)+qD(g)。
pC(g)+qD(g)。
已知:平均反应速率vC=1/2vA;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。
回答下列问题:
(1)化学方程式中,x= 、y= 、p= 、q= ;
(2)反应2min内,vA = ;
(3)反应平衡时,D为 2amol,则B的转化率为 ;
(4)已知该反应在不同温度下的平衡常数如下:
|
温度℃ |
1000 |
1150 |
1300 |
|
平衡常数 |
4.0 |
3.7 |
3.5 |
该反应的平衡常数表达式K=_____________,ΔH ________0(填“>”、“<”或“=”);
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率 (填“增大”、“减小”或“不变”) ;
②平衡时反应物的转化率 (填“增大”、“减小”或“不变”),理由是
。
【答案】
(1)2,3,1,6(4分)
(2)a/12 mol·L-1·min-1(2分)
(3)a/b×100%(2分)
(4)K= c (C)·c 6 (D)/c 2(A) ·c 3(B) (2分);<(2分)
(5)①增大(1分) ②减小(1分);体积减小,气体的压强增大,平衡向气体分子数少的方向(即逆反应方向)移动,因而使反应物转化率减小(1分)
【解析】略

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目


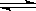 2NH3(g);已知:反应2min达到平衡 ,此时N2的浓度减少了2/3。
2NH3(g);已知:反应2min达到平衡 ,此时N2的浓度减少了2/3。