题目内容
【题目】有关卤族和碱金属元素性质的递变规律说法正确的是
A.卤族元素从F到I,对应氢化物的还原性逐渐增强
B.碱金属元素与O2反应均可得到多种氧化物
C.碱金属元素从Li到Cs,熔沸点逐渐升高
D.X2+2NaI=2NaX+I2(X为:F、Cl、Br)
【答案】A
【解析】
A.卤族元素从F到I,单质氧化性逐渐减弱,对应氢化物的还原性逐渐增强,A正确;
B.碱金属元素中Li与O2在室温下缓慢氧化与点燃条件下只生成一种氧化物,B错误;
C.碱金属元素从Li到Cs,熔沸点逐渐降低,C错误;
D.X2+2NaI=2NaX+I2(X为:Cl、Br),F2与水反应生成HF和O2,不能置换NaI水溶液中的I2,D错误;
故答案为A。

 名校课堂系列答案
名校课堂系列答案【题目】钡盐生产过程中排出大量钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:
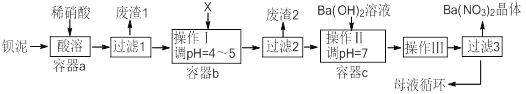
已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大,在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理 。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为 。
(3)结合本厂生产实际,X试剂应选下列中的 。
A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)废渣2为 。
(5)操作III为 。
(6)过滤III后的母液应循环到容器 中(选填a、b、c) 。
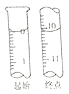
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。实验室用如图所示装置制备亚硝酸钠。请回答下列问题:
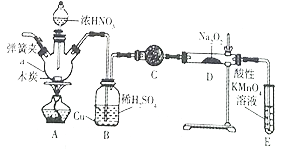
已知:①3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
(1)仪器a的名称是_____________。
(2)B装置中的主要现象是_______。C中的试剂可以是____________。
(3)D中反应生成NaNO2的化学方程式为_______。E装置的作用是______________。
(4)检验D装置中生成NaNO2
操作 | 现象 | 结论 |
_____________ | ____________ | 有NaNO2生成 |
(5) NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉中提取NaNO2后,配成溶液,再用0.0050mol/L的酸性高锰酸钾溶液滴定,滴定起始和终点的液面位置如图所示,计算隔夜熟肉中NaNO2的含量是_______mg/kg。