��Ŀ����
����Ŀ�������仯�����ת���Թ�ũҵ������������������Ҫ�����塣
��1�������ǵ����������ڼ��ֲ�ͬ����µ�ת����
����֪��2SO2(g)��O2(g)![]() 2SO3(g) ��H����196.6kJ��mol��1
2SO3(g) ��H����196.6kJ��mol��1
2NO(g)��O2(g)![]() 2NO2(g) ��H����113.0kJ��mol��1
2NO2(g) ��H����113.0kJ��mol��1
��SO2������NO2���巴Ӧ����SO3�����NO������Ȼ�ѧ����ʽΪ___��
��a.����Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ�䷴Ӧ�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ1��ʾ����Ӧ��c��___(�����ﵽ������δ����)ƽ��״̬��
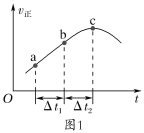
b.��ʼʱ���ֱ��ڸ������м����2molSO2(g)��2molNO2(g)����2molSO3(g)��2molNO(g)����Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������__(����>������������<��)��
��2������ʱ��Ũ��Ϊ0.1mol��L-1���ΪV L�İ�ˮ����μ���һ��Ũ�ȵ����ᣬ��pH�Ʋ����Һ��pH����������ı仯������ͼ2��ʾ��d�㴦������Һǡ����ȫ��Ӧ������ͼ2�ش��������⣺
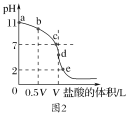
��b��c��d�����Ӧ����Һ�У�ˮ�����c(OH��)�ɴ�С��˳��Ϊ____��
�ڵζ�ʱ����b�㵽c��Ĺ����У����и�ѡ������ֵ���ֲ������___��
a.![]() b.
b.![]()
c.![]() d.
d.![]()
�۸��¶�ʱ��ˮ�ĵ���ƽ�ⳣ��K��___��
��3����������������Ⱦ��������������������Һ���ա������ķ�ӦΪ��
2NaOH��NO��NO2=2NaNO2��H2O
2NaOH��2NO2=NaNO3��NaNO2��H2O
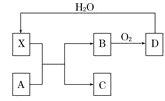
����Ӧ���Һ������������Һ�ֱ�ӵ���ͼ3��ʾ�ĵ����н��е�⣬A�Ҳ���N2��
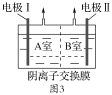
�ٵ缫����__����B�Ҳ�����������___��
��A��NO2-�����ĵ缫��Ӧ��__��
���𰸡�SO2(g)��NO2(g)![]() NO(g)��SO3(g)����H����41.8 kJ��mol��1 δ�� < d>c>b cd 10��5(��10��5 mol��L��1) �� O2 2NO2-��6e����4H2O=8OH����N2��
NO(g)��SO3(g)����H����41.8 kJ��mol��1 � < d>c>b cd 10��5(��10��5 mol��L��1) �� O2 2NO2-��6e����4H2O=8OH����N2��
��������
���������֪�����⿼���˹���ɡ���ѧƽ�ⳣ����������ʵĵ��롢���ԭ����֪ʶ�����ø�˹���ɡ���ѧƽ�ⳣ�����㹫ʽ��������ʵĵ�����ɡ����ԭ��������
(1) ����֪��a:2SO2(g)��O2(g)![]() 2SO3(g) ��H����196.6kJ��mol��1
2SO3(g) ��H����196.6kJ��mol��1
b:2NO(g)��O2(g)![]() 2NO2(g) ��H����113.0kJ��mol��1
2NO2(g) ��H����113.0kJ��mol��1
���ݸ�˹���ɣ���![]() ��, SO2 (g)+NO2(g)
��, SO2 (g)+NO2(g) ![]() NO(g)+SO3(g) ��H=-41.8 kJ��mol��1��
NO(g)+SO3(g) ��H=-41.8 kJ��mol��1��
�ʴ�Ϊ: SO2(g)��NO2(g)![]() NO(g)��SO3(g)����H����41.8 kJ��mol��1��
NO(g)��SO3(g)����H����41.8 kJ��mol��1��
��a.��Ӧ�ﵽƽ��ı�־��v��=v�����Ҳ��ٱ仯����c���Ӧ��v�����ڸı䣬�ʷ�Ӧ��c��δ��ƽ��״̬��
�ʴ�Ϊ: δ����
b.���������º��ݣ���ƽ�ⳣ������=��ʵ�����������ݾ���,SO2(g)+NO2(g) ![]()
NO(g)+SO3(g) ��H<0�����ڸ������м���2 molSO2(g) ��2molNO (g)��Ӧ�ų����������������м���2mol SO3(g)��2mol NO(g)����Ӧ�����������ݴ˷���ƽ�ⳣ������<��
�ʴ�Ϊ: <��
��2������b���Ӧ����Һ�У�����Ϊһˮ�ϰ����Ȼ�泥��Ҷ���Ũ����ȣ�����ͼ2��֪����Һ�ʼ��ԣ���һˮ�ϰ��ĵ���̶ȴ����Ȼ�淋�ˮ��̶ȣ���ʱˮ�ĵ����ܵ����ƣ���c���Ӧ����Һ�У�������Ϊһˮ�ϰ����Ȼ�泥�������Ũ�Ȳ���ȣ�����ͼ2֪��c����Һ�����ԣ����ʱһˮ�ϰ��ĵ���̶ȵ����Ȼ�淋�ˮ��̶ȣ�ˮ�ĵ��벻��Ӱ�죬��d���Ӧ����Һ�У�����Ϊ�Ȼ�泥��Ȼ�立���ˮ�⣬��Һ�����ԣ���ˮ�ĵ�����ٽ����ã�����b��c��d�����Ӧ����Һ�У�ˮ�����c��OH-����С˳��Ϊd>c>b��
�ʴ�Ϊ: d>c>b��
�ڵζ�ʱ����b�㵽c��Ĺ����У���Һ���Լ�����������ǿ��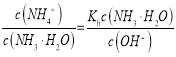 ����b�㵽c��Ĺ����У�c��OH-�����ϼ�С���ʸ�ֵ����a���������⣻
����b�㵽c��Ĺ����У�c��OH-�����ϼ�С���ʸ�ֵ����a���������⣻
��b�㵽c��Ĺ����У�c��H+����������c��OH-�����ϼ�С��![]() ��ֵ������b���������⣻
��ֵ������b���������⣻
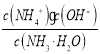 ��ֵ����һˮ�ϰ��ĵ���ƽ�ⳣ������Kb��NH3��H2O��ֻ���¶��йأ��ζ��������¶Ȳ��䣬��
��ֵ����һˮ�ϰ��ĵ���ƽ�ⳣ������Kb��NH3��H2O��ֻ���¶��йأ��ζ��������¶Ȳ��䣬��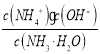 ��ֵ���䣬c�������⣻
��ֵ���䣬c�������⣻
 ��ֵ����笠����ӵ�ˮ��ƽ�ⳣ����b�㵽c������в��䣬d
��ֵ����笠����ӵ�ˮ��ƽ�ⳣ����b�㵽c������в��䣬d
�ʴ�Ϊ: cd��
��δ������ʱ����ˮŨ��Ϊ0.1mol/L����Һ��pH=11������Һ��![]() ��ˮ�ĵ���̶Ƚ�С����Һ��c(OH-)��c(NH4+)����һˮ�ϰ��ĵ���̶Ƚ�С����c(NH3��H2O)=0.1mol/L����ˮ�ĵ���ƽ�ⳣ��
��ˮ�ĵ���̶Ƚ�С����Һ��c(OH-)��c(NH4+)����һˮ�ϰ��ĵ���̶Ƚ�С����c(NH3��H2O)=0.1mol/L����ˮ�ĵ���ƽ�ⳣ��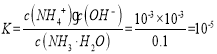 ��
��
�ʴ�Ϊ: 10��5(��10��5 mol��L��1)��
(3)��A�Ҳ���N2����֪A�ҵĵ������ҺΪNaNO3��NaNO2�Ļ����Һ��NO2-�ڵ缫���Ϸŵ�����N2���缫��ӦʽΪ2NO2-��6e����4H2O=8OH����N2������缫��Ϊ�������缫Ϊ��������B�ҵĵ������ҺΪNaOH��Һ��OH-�ڵ缫���Ϸŵ�����O2��
�ʴ�Ϊ: ���� O2�� 2NO2-��6e����4H2O=8OH����N2����

����Ŀ�������й����������ơ�ͼ�Ρ���;��ʹ�ò�������������ȷ���ǣ� ��
ѡ�� | A | B | C | D |
���� | 250 mL����ƿ | ��Һ©�� | ��ʽ�ζ��� | ������ |
ͼ�� |
|
|
|
|
��;��ʹ�ò��� | ����1.0 mol��L��1NaCl��Һ������ʱ���ӿ̶ȣ�����õ���ҺŨ��С��1.0 mol��L��1 | �ø�����ȡ��ˮ�еĵ⣬��Һʱ���������Ͽڷų� | ��������ȡ10.00mL ������ˮ��Һ | ����ʵ���н���������ΪҺ�� |
A.AB.BC.CD.D