题目内容
(5分)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2 2NH3
2NH3
(1)在N2+3H2 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为
;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为
;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·min-1
(3)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是
。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是
。
A.容器内气体密度保持不变
B.容器内温度不再变化
C.断裂1mol N≡N键的同时,断裂6 mol N—H键
D.反应消耗N2、H2与产生NH3的速率之比1︰3︰2
(1) B (2分)(2) B (1分)(3)BC (2分)
【解析】(1)υ(NH3)=2υ(N2)=0.3
mol·L-1·s-1=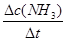 =
=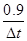 ,故△t=3 s
,故△t=3 s
(2)将四选项以方程式系数转换为以同一物质来表示反应速率即可求得答案为B
(3)注意本题环境为绝热、恒容:
A:由于气体的质量和容积不变,故密度也是定值,不能做为平衡状态的判断标志。
B:只要没有到达平衡状态,反应就会有热量的放出或吸收,在绝热的环境中,容器内的温度就会变化,当温度不变时,说明也就是到了平衡状态;
C:断裂1mol N≡N键的同时,断裂6 mol N—H键恰好说明了正逆反应速度相等
D:任何状态下三者的速率比均为1︰3︰2,不能做为判断标志。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案 2NH3
2NH3 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ; 2NH3
2NH3