题目内容
设NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,2.24 L CCl4所含的原子数为0.5 NA
B.100 m L 0.1 mol/L的 NaCl 溶液中,所含微粒总数为0.02 NA
C.1.7 g 的OH-中含有的电子数为NA
D.78 g Na2O2 与足量水反应转移电子数为2 NA
C
【解析】
试题分析:A.标准状况下,CCl4是液体,其摩尔体积不为22.4L,故2.24 L CCl4所含的原子数不为0.5 NA,故错误。B. 100 m L 0.1 mol/L的 NaCl 溶液的物质的量为0.1×0.1=0.01mol,溶液中含有的微粒为Na+、Cl-、H+、OH-、NaCl、H2O等,含有的微粒数不为0.02 NA,故错误。C.OH-的相对分子质量为17g/mol,1.7gOH-的物质的量为0.1mol,1molO原子含有8mol电子,1molH原子含有1mol电子,1molOH-基团本身含有1mol负电荷,因此1molOH-含有10mol电子,故0.1molOH-含有的电子数为NA,故正确。D. Na2O2的相对分子质量为78g/mol,78 g Na2O2为1mol,与水反应的方程式为:2Na2O2+2H2O= 4NaOH+O2↑,1mol Na2O2转移电子1mol,因此转移电子数为NA。故错误。
考点:考查物质的量与阿伏伽德罗常数的转化关系。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_________________________________。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论___________________。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是________________(填字母序号)。
A.溶液温度下降 B.溶液温度升高 C.滴入酚酞后呈浅红色 D.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。
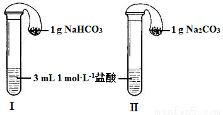
①两试管中均产生气体,________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是__________。
A.装置Ⅰ的气球体积较大 B.装置Ⅱ的气球体积较大
C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应_________(写离子方程式)。 |
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为_______________。