题目内容
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暧,研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C+___K2Cr2O7+___—___CO2↑+ ___K2SO4+ ___Cr2(SO4)3+___H2O
①完成并配平上述化学方程式。
②在上述方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式________
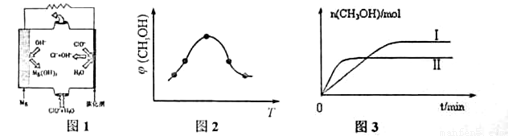
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为_____________________。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)(g)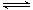 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①该反应的平衡常数表达式为K_______。
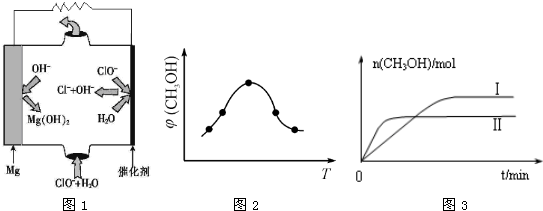
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数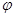 (CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0
(填 “>”、“<”或“
=” )。
(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0
(填 “>”、“<”或“
=” )。
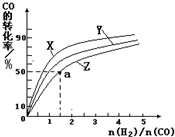
③在同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线 I、II对应的平衡常数大小关系为KI_______KII (填“>”、“<”或“ = ”)。
(1)配平:3 2 8 H2SO4 3 2 2 8,电子转移略
(2)①2MgSO4 + CO 2MgO
+ SO2 + CO2 + SO3
2MgO
+ SO2 + CO2 + SO3
②Mg + ClO- + H2O = Cl- + Mg(OH)2
(3)①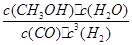 ②< ③>
②< ③>
【解析】
试题分析:(1)根据氧化还原反应得失电子守恒,可配平方程式,根据原子守恒可确定所缺反应物为硫酸。
(2)①根据题意,可知CO还原MgSO4的产物为CO2、MgO、SO2、SO3,依据SO2、SO3物质的量相等和氧化还原反应得失电子守恒,可写出方程式。
②根据图1,可知Mg结合OH-生成Mg(OH)2,ClO-和水结合生成Cl-和OH-,据此可写出电池反应。
(3)①依据化学平衡常数的概念可直接写出平衡常数的表达式。
②反应温度较低时,反应速率较慢,温度升高,反应速率加快,甲醇含量增加;但随温度升高,甲醇含量逐渐减小,说明升高温度反应逆向移动,逆反应吸热,正反应放热,△H<0。
③根据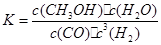 ,可知甲醇物质的量越高,则CO、H2的物质的量越低,则K越大,因此KI>KII。
,可知甲醇物质的量越高,则CO、H2的物质的量越低,则K越大,因此KI>KII。
考点:考查氧化还原反应方程式的配平及电子转移的标注,图像的分析,电池的总反应式书写,化学平衡常数,影响化学平衡的因素等。

(12分)欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
物质 n/mol T/℃ |
活性炭 |
NO |
E |
F |
|
初始 |
2.030 |
0.100 |
0 |
0 |
|
T1 |
2.000 |
0.040 |
0.030 |
0.030 |
|
T2 |
2.005 |
0.050 |
0.025 |
0.025 |
①请结合上表数据,写出NO与活性炭反应的化学方程式 。
②根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质, CO 为阳极燃气,空气与 CO2 的混和气为阴极助燃气,制得在 650 ℃下工作的燃料电池,其阳极反应式:2CO + 2CO32- =4CO2 +4e- 则 阴极反应式: ,电池总反应式: 。
 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
 CH3OH(g)的平衡常数K =
。
CH3OH(g)的平衡常数K =
。